肿瘤微环境(TME)中的T细胞在肿瘤免疫监测中发挥着关键作用。通常,T细胞浸润程度越高的恶性肿瘤患者,其生存率越高。目前,免疫检查点疗法(ICT)为代表的肿瘤免疫治疗正是利用这一机理,通过消除CTLA-4和PD-1/PD-L1等阻碍T细胞功能的抑制性信号而恢复T细胞的功能。尽管ICT在各类肿瘤中显示出前所未有的临床活性,但只有少数接受治疗的患者从中获益。肿瘤突变负荷(TMB)水平、细胞毒性T细胞(CTL)浸润程度、PD-L1水平、肿瘤微环境中的免疫抑制因子和肠道菌群等诸多因素对ICT耐药有影响。越来越多的研究关注联合治疗方法,以消除ICT耐药的诱发因素,进而提高治疗效果。无论ICT本身或联合治疗,最终目的是提高T细胞介导的细胞毒性和细胞溶解活性。因此,T细胞在肿瘤实质中的存在是获得最佳治疗效果的关键前提。
基于肿瘤活检标本的组织学检查,实体瘤的肿瘤微环境划分为三个主要的免疫相关表型,即:免疫炎症型、免疫排斥型、免疫沙漠型。免疫炎症型和免疫沙漠型分别以大量的T细胞浸润和极少的T细胞浸润肿瘤(尤其肿瘤实质)为特征。尽管免疫排斥型的肿瘤中存在大量的免疫细胞,但这些免疫细胞无法穿透肿瘤实质,而是仅被限制在癌巢周围的基质中。免疫沙漠型和免疫排斥型均被视为非炎症性“冷”肿瘤。探索不同免疫表型间的差异分子和细胞成分,将有助于揭示肿瘤免疫逃逸和免疫治疗耐受的潜在机制。
乳腺癌仍是女性中最常见的肿瘤,约占女性肿瘤发病率的30%、相关死亡率的15%。在临床上,乳腺癌可以根据ER、PR、HER2的表达分为几种亚型,而三个受体均不表达的三阴性乳腺癌(TNBC)是一种转移率高、预后差、治疗选择有限的侵袭性亚型。如今,越来越多的证据表明,与其他亚型相比,三阴性乳腺癌是一种更具有免疫原性的亚型,这也表明三阴性乳腺癌患者更容易从免疫治疗中获益。然而,ICT对三阴性乳腺癌患者中的单药疗效很有限。研究表明,近一半的三阴性乳腺癌为免疫排斥型,约1/3为免疫沙漠型,这表明将肿瘤由“冷”免疫转为“热”免疫,特别是逆转免疫排斥型肿瘤的T细胞排斥,可能会提高三阴性乳腺癌的抗肿瘤免疫应答。
研究路线
研究内容
1、FGFR在三阴性乳腺癌中的激活与T细胞排斥相关
作者首先使用深度学习对TCGA中的三阴性乳腺癌数据集进行了肿瘤免疫微环境(TIME)分析,分析表明,约三分之一的三阴性乳腺癌被归类为免疫排斥型。为了阐明促使T细胞排斥的关键因素,作者从TCGA数据库中检索了三阴性乳腺癌的转录组测序数据,并比较了免疫排斥型和免疫炎症型样本之间的基因标志。分析表明,FGFR通路激活在免疫排斥组中显著富集。基于FGFR1-4的表达值计算FGFR评分。FGFR评分高的乳腺癌有较低的CD8+T细胞浸润和较高的T细胞排斥评分。接下来,作者进一步分析了乳腺癌样本的肿瘤微环境中23种基质细胞与FGFR评分的相关性。结果表明,FGFR评分与CD8+T细胞和M1巨噬细胞呈负相关,与成纤维细胞和M2巨噬细胞呈正相关。
此外,作者基于肿瘤免疫功能障碍和排斥(TIDE)系统的分析表明,FGFRs的表达与多类肿瘤,包括:乳腺癌、结直肠癌、头颈癌、肺癌、皮肤癌和卵巢癌中细胞毒性T淋巴细胞(CTL)的浸润呈负相关。与其他FGFR相比,FGFR1与T细胞浸润的有更好的负相关。然后作者对系统中三阴性乳腺癌队列的免疫表型进行了特征分析,基于肿瘤免疫微环境中CD3的免疫组化(IHC)结果,超过一半的三阴性乳腺癌被归为免疫排斥型,这与之前的研究一致。FGFR1在三阴性乳腺癌队列中的免疫组化结果也表明,FGFR1在免疫排斥组中的表达高于免疫炎症组。上述结果表明,FGFR通路与T细胞排斥相关。此外,Kaplan-Meier数据库的分析证实,FGFR的高表达与三阴性乳腺癌患者较短的总生存期相关。
2、FGFR的阻断可增强T细胞在体内对三阴性乳腺癌的浸润
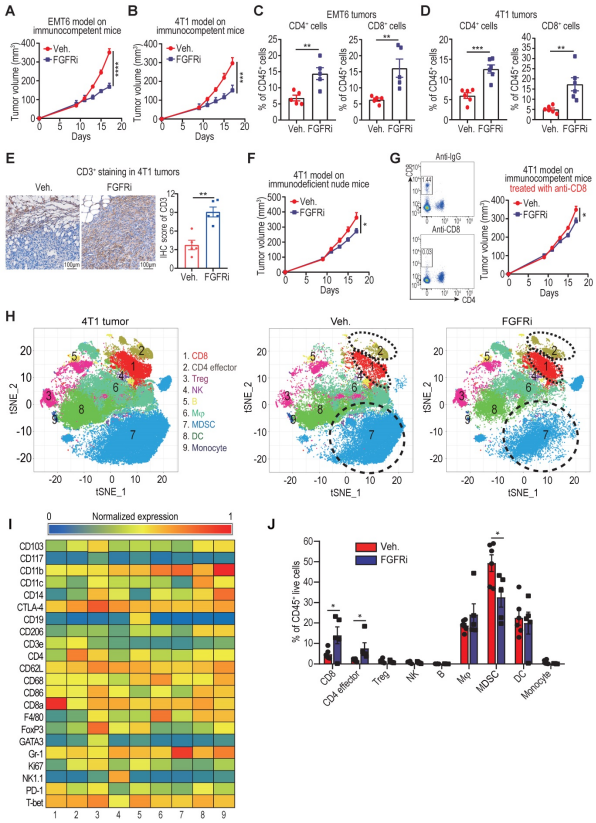
作者使用三阴性乳腺癌同源小鼠模型(EMT6和4T1细胞系)进一步研究了FGFR的表达和T细胞浸润之间的关系。结果表明,在具有免疫活性BALB/c荷瘤小鼠(EMT6和4T1细胞系)中,选择性FGFR抑制剂(FGFRi):Erdafitinib抑制FGFR通路,可显著抑制肿瘤生长,增加CD3+(CD4+和CD8+) T细胞的浸润。有研究表明,FGFRi可以抑制肿瘤细胞的增殖,作者进而研究了FGFRi诱导的T细胞浸润对观察到的肿瘤缩小的影响。作者接下来用免疫缺陷小鼠来测试FGFRi的抗肿瘤活性。当CD8+T细胞在裸鼠胸腺缺失,或使用CD8抗体在BALB/c小鼠中损耗时,FGFRi对肿瘤生长的抑制作用明显减轻,说明FGFRi介导的抗肿瘤活性部分依赖于CD8+T细胞。为了评估FGFR阻断对肿瘤免疫微环境的整体影响,作者使用CyTOF分析了对照组或FGFRi处理组小鼠的4T1肿瘤中的CD45+免疫细胞。分析表明,FGFRi处理小鼠的4T1肿瘤中的CD8+T细胞和CD4+T细胞显著增加,骨髓来源的抑制细胞减少,表明增强了抗肿瘤免疫。
3、FGFR的阻断通过调控成纤维细胞而诱导T细胞浸润
由于T细胞的运动有助于T细胞浸润到肿瘤中,作者接下来检测了FGFR的阻断对T细胞运动的直接影响。transwell迁移实验显示,在体外经Erdafitinib处理后,脾脏T细胞迁移没有明显变化,提示FGFR无法直接影响T细胞浸润。在肿瘤微环境的基质细胞中,FGFRs的表达与成纤维细胞显著相关。越来越多的证据指出,肿瘤相关成纤维细胞(CAFs)在促进T细胞排斥中发挥关键作用。作者接下来通过对成纤维细胞标记物:α-SMA的免疫组化染色证实,大量的肿瘤相关成纤维细胞分布于免疫排斥型三阴性乳腺癌中。此外,α-SMA和CD3在免疫排斥型肿瘤中的双重免疫荧光(IF)染色显示,肿瘤相关成纤维细胞多分布在癌巢周围,保护肿瘤细胞免受T细胞的攻击。作者基于肿瘤免疫单细胞中心(TISCH)数据库分析表明,FGFR1主要在乳腺癌肿瘤微环境的成纤维细胞中表达。此外,在单细胞数据集(GSE114727)中,根据FGFR1的表达对乳腺癌样本进行分组,结果也表明,FGFR1高表达组的肿瘤微环境中成纤维细胞更多,CD8+T细胞浸润更少。作者对收集的人三阴性乳腺癌样本进行FGFR1和α-SMA的双重免疫荧光染色也证明,FGFR1在肿瘤相关成纤维细胞中显性表达。为了探索FGFRs在肿瘤相关成纤维细胞中是否调控T细胞排斥,作者对脾T细胞与对照、或FGFRi处理的肿瘤相关成纤维细胞共培养,并进行transwell迁移试验。结果显示,FGFRi在肿瘤相关成纤维细胞存在时显著增强了T细胞的迁移,说明FGFR的阻断主要通过调控肿瘤相关成纤维细胞而增加T细胞的浸润。
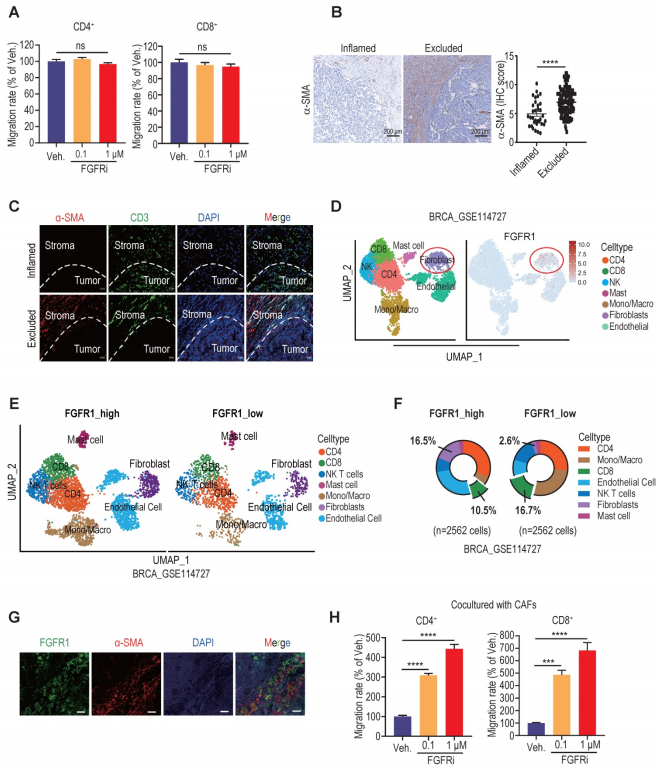
4、FGFR的阻断抑制了肿瘤相关成纤维细胞的增殖、迁移以及VCAM-1的分泌
肿瘤相关成纤维细胞是肿瘤基质的关键组成部分,作为物理屏障和免疫抑制分子的来源冷却免疫微环境。为了进一步挖掘FGFR介导的T细胞排斥机制,作者随后检测了FGFR阻断对肿瘤相关成纤维细胞的具体生物学影响。
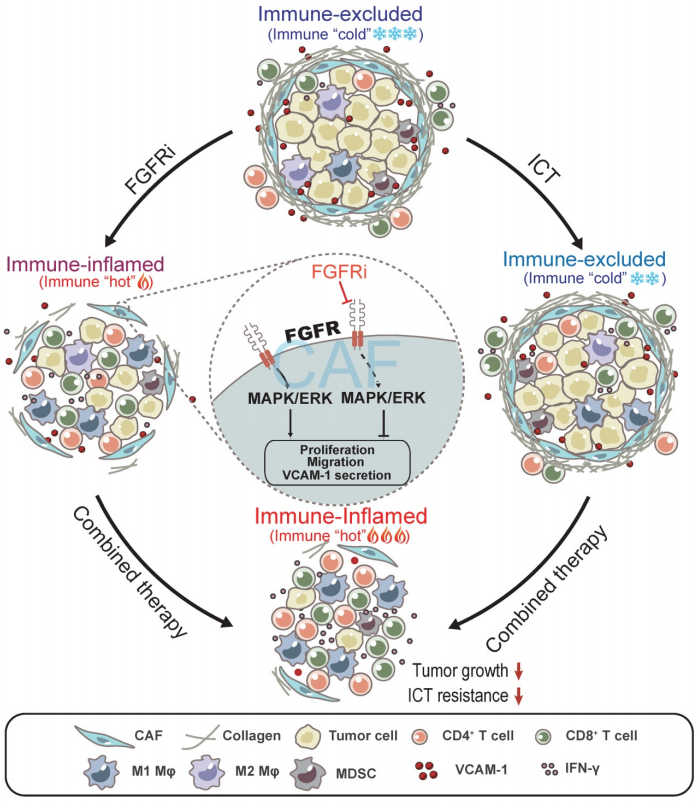
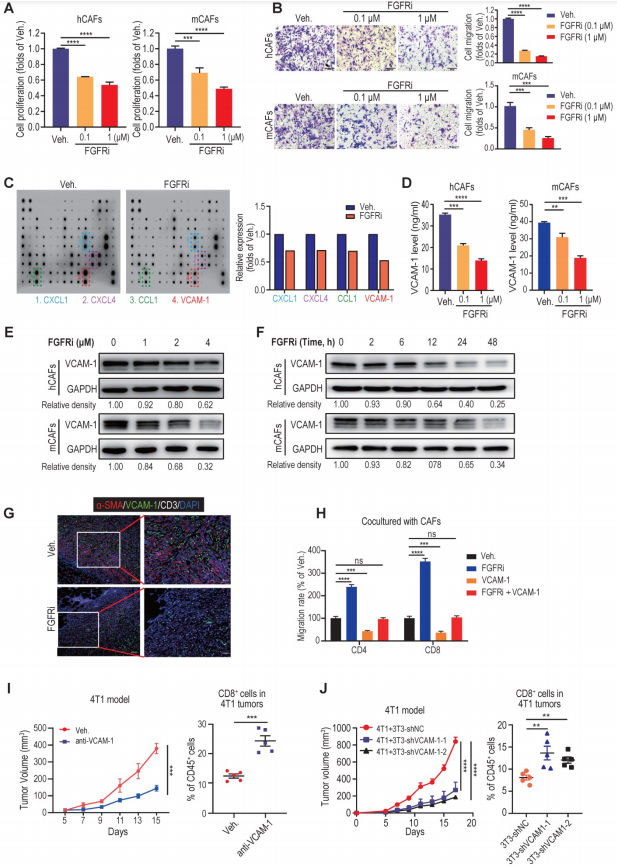
CCK-8试验表明,在0.1和1 μM浓度下,FGFRi Erdafitinib显著抑制人肿瘤相关成纤维细胞 (hCAFs)、小鼠肿瘤相关成纤维细胞(mCAFs)和3T3小鼠成纤维细胞的增殖,而在相同浓度下,FGFRi对三阴性乳腺癌细胞的增殖没有显著影响。此外,transwell迁移实验显示,FGFRi显著抑制成纤维细胞迁移。这些观察结果表明,FGFR的激活有可能通过促进肿瘤相关成纤维细胞的增殖和迁移来帮助肿瘤相关成纤维细胞建立物理“围栏”。接下来,为了阐明FGFRs是否也通过产生免疫抑制因子来促进T细胞排斥,作者使用抗体芯片比较了对照组和FGFRi处理的小鼠肿瘤相关成纤维细胞分泌的细胞因子表达谱,由此而确定了一组受FGFRi调控的细胞因子。其中,血管细胞粘附分子-1 (VCAM-1)是FGFRi下调最多的细胞因子之一,被报道可增强肿瘤免疫逃避,主要表达于肿瘤相关成纤维细胞中。ELISA和western blot证实,FGFRi在人肿瘤相关成纤维细胞、小鼠肿瘤相关成纤维细胞和3T3细胞中对VCAM-1有抑制作用。FGFRi对VCAM-1的抑制作用随着处理时间的延长而逐渐增强。ELISA检测表明,VCAM-1在FGFRi处理的4T1和EMT-6荷瘤小鼠的肿瘤中表达水平降低。此外,4T1荷瘤小鼠的三重免疫荧光结果显示,在FGFRi处理后,肿瘤相关成纤维细胞数量减少,VCAM-1表达减少,CD3+T细胞浸润增加。在肿瘤相关成纤维细胞存在的情况下,VCAM-1的添加显著减弱了FGFRi对T细胞迁移的促进作用。此外,在体内使用VCAM-1中和抗体也显著抑制肿瘤生长,增强T细胞浸润。VCAM-1表达敲除的3T3成纤维细胞与4T1细胞联合移植到BALB/c小鼠中,与3T3成纤维细胞与4T1细胞联合移植的对照组相比,肿瘤生长明显减少,肿瘤浸润性T细胞显著增加。这些结果表明,FGFR信号通路的阻断可能通过破坏肿瘤相关成纤维细胞建立的物理屏障和抑制肿瘤相关成纤维细胞分泌的VCAM-1而促进T细胞浸润。
5、MAPK/ERK通路的激活可以维持体外肿瘤相关成纤维细胞中FGFR的功能
为了揭示与FGFR功能相关的信号通路,作者对GEO中乳腺癌数据集进行了基因集富集分析(GSEA)。结果表明,FGFRs与MAPK/ERK信号通路高度相关,western blot的验证结果显示,FGFRi在肿瘤相关成纤维细胞中剂量依赖性显著下调了MAPK/ERK信号通路的激活。选择性抑制剂:U0126对ERK通路的抑制可显著抑制人肿瘤相关成纤维细胞、小鼠肿瘤相关成纤维细胞和3T3成纤维细胞的增殖和迁移。U0126还可显著抑制成纤维细胞中VCAM-1的表达和分泌。这些研究结果表明,MAPK/ERK信号通路在肿瘤相关成纤维细胞的激活可能与FGFR功能的维持有关,并参与诱导T细胞排斥。

6、FGFR的阻断增强了ICT的治疗效果
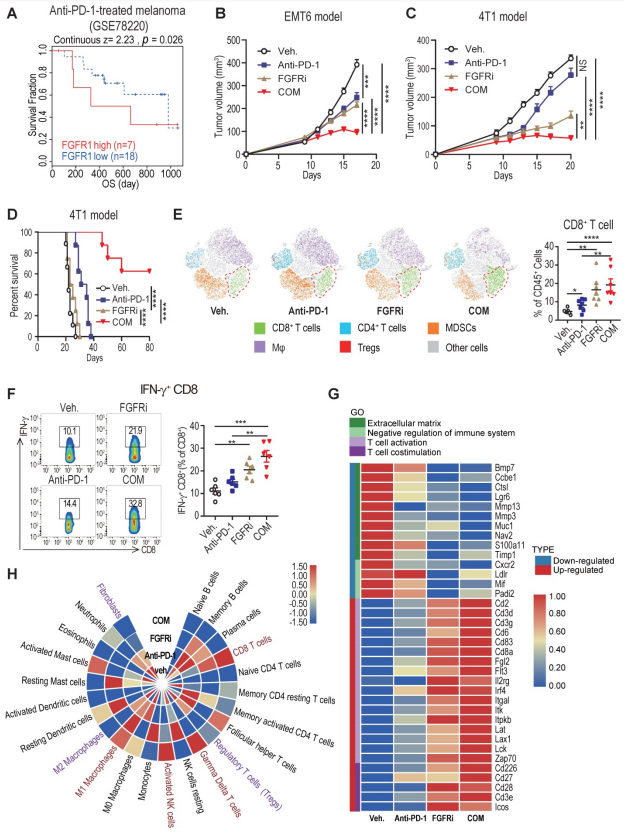
越来越多的研究证明,T细胞排斥导致了免疫治疗耐药,大家都在寻求将免疫“冷”肿瘤转变为“热”肿瘤的方法,以达到对ICT更高的响应。为了研究阻断FGFR通路是否会逆转T细胞排斥以改善癌症患者的ICT治疗,作者进一步探讨了FGFR的高表达是否与免疫治疗耐药相关。对接受抗PD-1药物:pembrolizumab治疗的黑色素瘤患者(GSE78220)的分析表明,与有反应的患者相比,无反应的患者在治疗前肿瘤中的FGFR1 mRNA表达相对较高。FGFR1高表达的抗PD-1治疗患者的总生存期比FGFR1低表达患者要短得多。另一个独立数据集的分析证实,抗PD-1治疗患者的FGFR3表达与无进展生存期具有相关性。为了检测FGFR的抑制是否会增强PD-1阻断的抗肿瘤活性,在ICT耐药的4T1模型和ICT敏感的EMT6模型中,作者分别用对照、PD-1抗体、FGFRi、FGFRi 与抗PD-1联合治疗4T1和EMT6肿瘤。结果表明,FGFRi与ICT联合治疗与单独FGFRi或单独ICT治疗相比,获得了最好的治疗效果。值得注意的是,联合治疗组中约60%的患者肿瘤完全缓解,而其他各组均无明显缓解,同时,CD4+和CD8+T细胞浸润明显增加,骨髓源性抑制细胞(MDSC)、巨噬细胞(Mφ)和调节性T细胞(Treg)浸润减少。
此外,在FGFRi治疗的4T1肿瘤中检测到IFN-γ+CD8+T细胞浸润增加,而在FGFRi+ICT联合治疗组中进一步提高,这表明增强CD8+T细胞的细胞毒性也有助于FGFRi阻断介导的抗肿瘤免疫。基于TIDE系统的FGFRs和T细胞功能障碍之间的相关性分析也表明,FGFRs诱导了T细胞功能障碍(CTLs的细胞毒性/细胞溶解活性下调)。为了深入了解FGFR抑制的抗肿瘤免疫机制,作者通过转录组测序比较了不同治疗的4T1肿瘤的整体转录组差异。与对照相比,FGFRi抑制了细胞外基质合成相关基因,如:BMP7、MMP13和MMP3的表达,这些基因可能有助于肿瘤相关成纤维细胞建立物理屏障。α-SMA在FGFRi处理的4T1肿瘤中的表达也显著降低,表明FGFRi在体内显著抑制了肿瘤相关成纤维细胞的浸润,破坏了肿瘤相关成纤维细胞建立的物理屏障。此外,参与免疫系统负向调节的基因在FGFRi处理组中下调,而与T细胞激活和共刺激相关的基因上调。值得注意的是,联合治疗进一步加强了这些趋势。转录组测序的进一步分析表明,与对照组相比,联合治疗组的CD8+T细胞、γδ T细胞、激活的NK细胞和M1 Mφ明显增加,而成纤维细胞、Treg和M2 Mφ明显减少。这些研究表明,FGFR的阻断可以与ICT协同促进抗肿瘤免疫反应。
研究结论
在三阴性乳腺癌免疫小鼠模型中,Erdafitinib阻断FGFR通路可显著抑制肿瘤生长,增加T细胞浸润。从机制上讲,FGFR阻断通过下调肿瘤相关成纤维细胞中的MAPK/ERK通路而抑制肿瘤相关成纤维细胞的增殖、迁移和血管细胞粘附分子1 (VCAM-1)的分泌,从而打破肿瘤相关成纤维细胞在肿瘤免疫微环境中建立的物理和化学屏障,促进T细胞浸润。此外,作者还证明了FGFR的抑制联合免疫检查点疗法可以很好的改善对三阴性乳腺癌肿瘤模型的治疗效果。
参考文献
Wu Y, Yi Z, Li J, Wei Y, Feng R, Liu J, Huang J, Chen Y, Wang X, Sun J, Yin X, Li Y, Wan J, Zhang L, Huang J, Du H, Wang X, Li Q, Ren G, Li H. FGFR blockade boosts T cell infiltration into triple-negative breast cancer by regulating cancer-associated fibroblasts. Theranostics. 2022 May 27;12(10):4564-4580. doi: 10.7150/thno.68972. PMID: 35832090; PMCID: PMC9254240.





