众所周知,肿瘤和宿主的免疫反应之间持续的相互作用,加速了肿瘤的发展和进展。肿瘤微环境和免疫成分在肿瘤进展和转移中起重要作用。中性粒细胞作为人类免疫系统中数量最多的细胞,在肿瘤微环境中起着举足轻重的作用。外周血中性粒细胞已被提议作为癌症患者风险分级的生物标志物。大多数有关中性粒细胞与淋巴细胞的比率(NLRs)的临床证据都支持中性粒细胞促进肿瘤进展而非抑制的观点。NLRs的增加反映出造血系统向髓系偏移、淋巴造血功能下降、免疫系统功能降低、预后不良。随着疾病的进展和复发,中性粒细胞数量或NLR上升;而这些参数随着疾病的恢复而下降。肿瘤内的中性粒细胞常被称为肿瘤相关中性粒细胞(TANs)。然而,TANs与临床结果之间的关系是矛盾的,表明TANs的功能具有异质性。在大多数情况下,TANs的存在与多种肿瘤,如:肾细胞癌和胰腺导管腺癌的预后不良有关。TANs反映了宿主的一种天然细胞毒性,其释放了大量发挥促肿瘤作用的因子,包括:细胞外基质重塑、血管生成、促进肿瘤生长和侵袭等。在晚期胃癌中,女性的预后似乎优于男性,这在一定程度上可以解释中性粒细胞功能的差异。
中性粒细胞胞外诱捕网(NETs)是一种网状结构,由濒死的中性粒细胞将解聚的DNA染色质释放到细胞外空间而形成,其主要功能是杀死有害微生物。DNA染色质通过瓜氨酸化而解聚,然后与瓜氨酸化的组蛋白和含有颗粒状酶的中性粒细胞胞质内容物结合,被称为“NETosis”。事实上,并不是所有的中性粒细胞都会释放NETs。只有一小部分中性粒细胞有这种能力。例如,在脂多糖刺激下,OLFM4的表达与产生NETs的中性粒细胞的百分比一致性很好,而CD177-中性粒细胞不能产生NETs。NETosis作为感染性和无菌性刺激均可触发的固有和适应性免疫反应的重要一步,其在肿瘤发生发展中的作用仍有争议。从抗肿瘤免疫的角度来看,NETs通过激活免疫系统而抑制肿瘤生长。中性粒细胞通过NETs与T细胞相互作用,降低激活阈值,直接激活T细胞。然而,更多的研究表明,肿瘤可以引导中性粒细胞形成NETosis,促进转移。据报道,肿瘤触发的NETs可以保护肝细胞癌细胞免受多种细胞毒素的影响,并帮助其更具侵袭性。
髓过氧化物酶(MPO)是一种血红素过氧化物酶,主要储存在中性粒细胞的嗜蓝颗粒中,当中性粒细胞受到刺激时分泌,被认为是NETs形成的基本要素。常用的MPO-DNA复合物的ELISA检测方法已被用于评估人血浆中NETs的丰度。晚期食管癌、胃癌和肺癌患者的循环NETs水平均高于局部肿瘤患者和健康对照者,而与外周血相比,肿瘤患者原发灶中NETs的形成可能是更直接的预后指标。
研究路线
研究内容
1、19个NETs相关特征基因的泛癌种鉴定
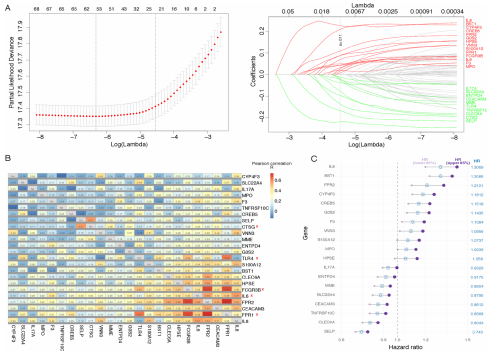
泛癌NETs相关特征模型的构建及验证流程如下图所示。首先,将TCGA泛癌训练集中的69个NETs初始生物标志物纳入LASSO回归分析,得到了24个非零系数的NETs相关基因。随后对这些基因进行配对相关性分析,作者发现其中一些基因具有相似的表达模式,CTSG与SELP、IL-6与IL-8、IL-6与FRP2、TLR4与FPR1、FCGR3B与FPR1、FCGR3B与FPR2、FPR1与FPR2的相关系数均较高。因此,作者剔除了CTSG、IL-6、TLR4、FPR1和FCGR3B,将剩下的19个NETs相关基因用于进一步的模型构建。

对19个NETs相关基因进行Cox回归分析,根据其归一化表达水平得出评分(NETs评分),并观察单个基因各自的预后风险比。分析表明,MPO作为NETosis过程的重要成员也参与了该模型。
2、泛癌NETs评分的综合研究
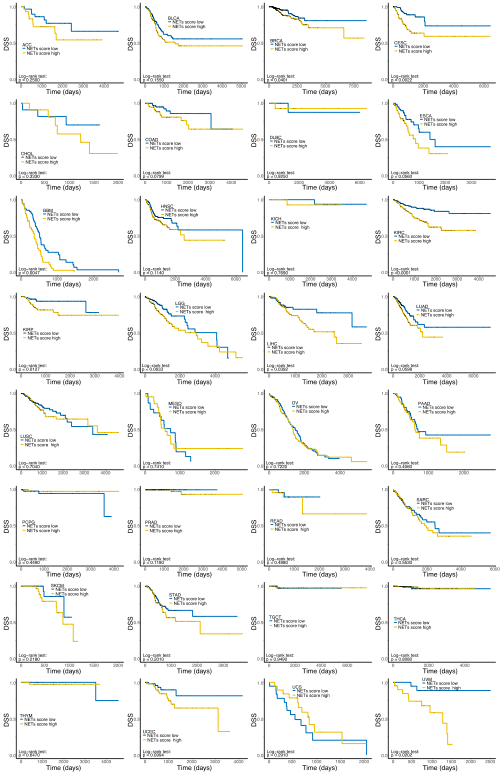
NETs评分具有明显的器官特异性,来自大脑和胃肠道的肿瘤,NETs评分一般较高,而来自某些分泌腺的肿瘤,如:前列腺腺癌、甲状腺癌、乳腺癌(BRCA),NETs评分一般较低。作者基于患者的NETs评分是否高于人群的中位数,将TCGA训练队列中的患者分为:高危组或低危组。与低危组相比,NETs评分较高的泛癌患者与各种预后不良指标相关,包括:疾病特异性生存期(DSS)、总生存期(OS)和无进展生存期(PFI)。下图展示了训练集中各类型肿瘤的Kaplan-Meier生存曲线(包括:DSS、OS、PF)。单因素Cox分析用于表征NETs评分对预后的影响,结果显示,在大多数类型的癌症中,NETs评分与预后不良相关。
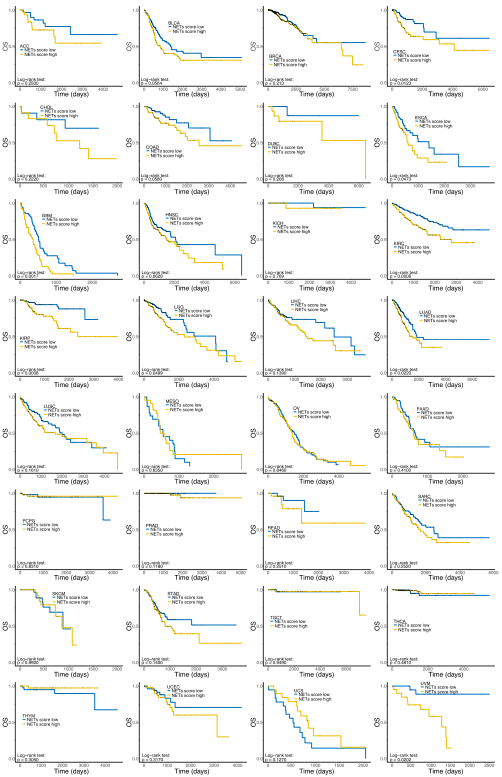
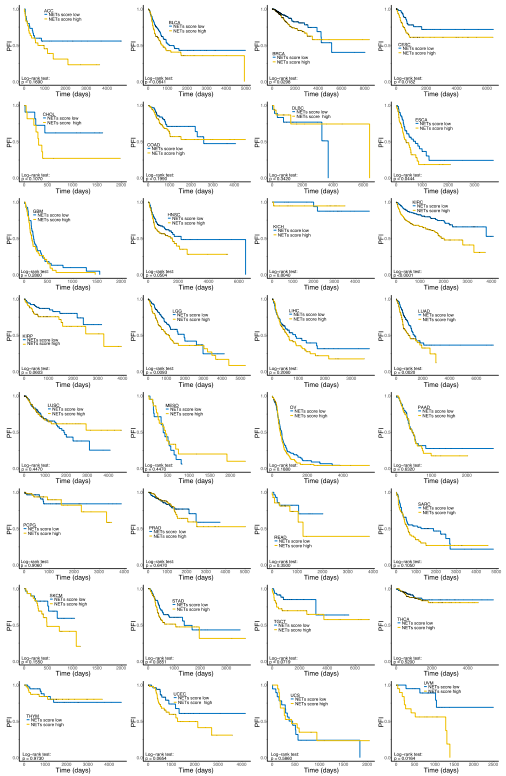
为了检验NETs评分的有效性和通用性,作者首先在TCGA测试集中验证了NETs评分的预后效应。与训练集结果一致,测试集的生存分析显示,NETs得分越高,患者预后越差。纳入NETs评分和癌症类型的多因素Cox比例风险模型表明,NETs评分是TCGA测试集中患者总生存期的独立预测因子(p=0.0070, HR=1.22)。作者观察到NETs评分对多种肿瘤的预后具有很强的预测能力,包括:肾透明细胞癌(p=0.0001)、结肠癌 (p=0.0197)和肺腺癌(p=0.0067)。然而,对于NETs评分相对较低的乳腺癌, NETs评分的预后预测价值无法在测试队列中重现(p=0.1060)。作为女性诊断最常见的癌症,TCGA中乳腺癌样本数据量非常大,导致训练队列模型统计效率高,存在过拟合问题。同时,作者发现NETs评分对来自同一器官的肿瘤有不同的影响,它与肺腺癌患者的预后不良显著相关,但与肺鳞癌(LUSC)患者的预后不相关,尽管后者的NETs评分高于前者,这表明NETosis在肿瘤进展中的作用不仅受其宿主器官的影响,还与肿瘤的性质有关。
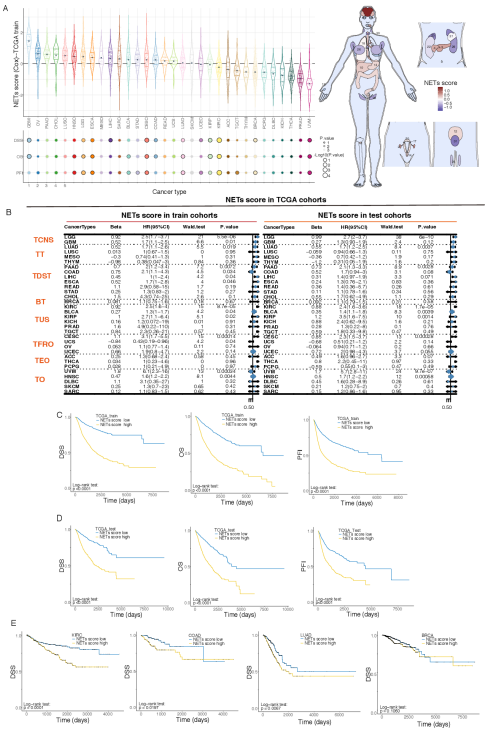
3、NETs相关特征在其他独立数据集中的验证
为了进一步证实NETs评分的预后价值,作者将其应用于多个外部验证队列,并获得了类似的结果。作者从CGGA数据库中获得了651例胶质瘤的mRNA矩阵和临床信息,证明了NETs评分越高,胶质瘤患者的预后越差,尤其是那些疾病级别高(III级或IV级)的患者。乳腺癌的外部验证表明,在8个验证数据集中,NETs评分在7个数据集中与患者的预后没有显著相关性,因此,NETs评分并不是一个可靠的乳腺癌患者预后的预测指标。这与TCGA队列的验证结果一致。作者收集了额外的非小细胞肺癌数据集,以确认NETs评分对肺腺癌和肺鳞癌患者的确切预后影响。同样,作者发现NETs评分与肺腺癌患者的预后显著相关(GSE8894:p=0.0087, GSE43767:p=0.0023),但与肺鳞癌患者的预后无显著相关性(GSE19188:p=0.5970, GSE67061:p=0.4970)。
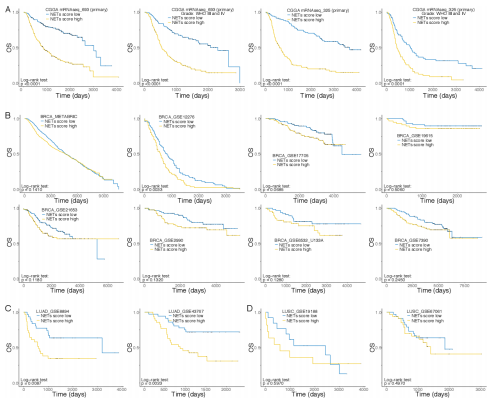
4、基于NETs评分的nomogram泛癌生存预测模型的构建
为了提供一个可读且可量化的NETs特征测定,以便于临床预测不良事件的概率,作者构建了一个综合的nomogram预测模型,该模型纳入了NETs评分和包括患者年龄和癌症类型在内的几种临床病理特征。绘制的3年疾病特异性生存期的校准曲线显示,校准曲线为一条通过坐标轴原点、斜率为1的直线,与标准曲线几乎重合,表明nomogram预测的生存概率与实际生存概率非常接近。同时,作者发现在训练集和测试集中,nomogram预测的AUC优于NETs评分单独预测的AUC(训练集: 0.726 vs 0.700, 测试集: 0.718 vs 0.661),说明纳入多种临床因素后,nomogram模型的预测能力会更好。此外,作者发现单独的NETs评分和综合nomogram的净收益(NB)均大于0,且用于临床评估的决策分析曲线的最大净收益大于15%,表明NETs评分与其他临床特征协同预测预后的重要性。
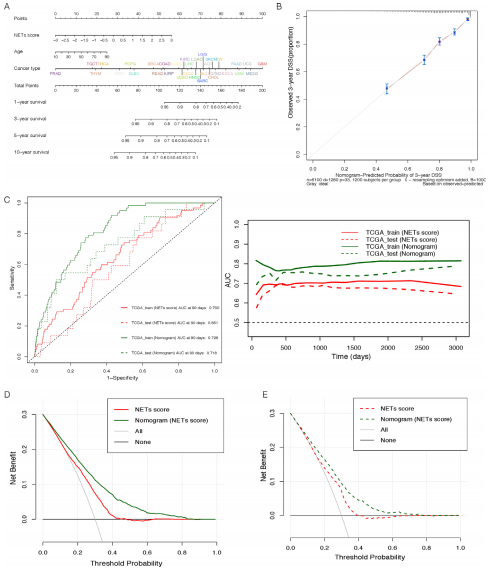
5、肿瘤的NETs和恶性特征
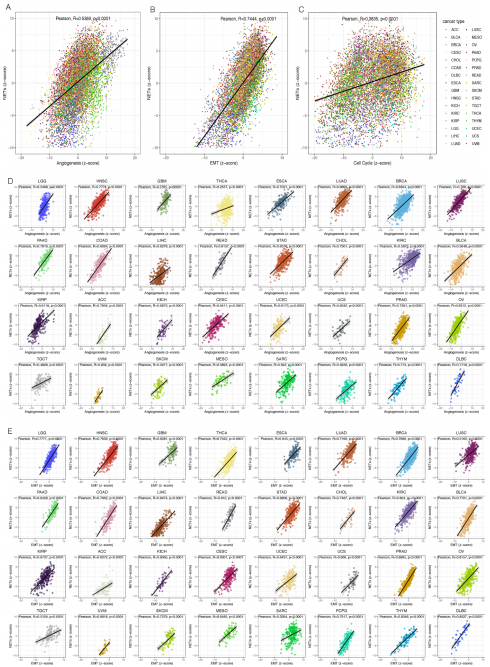
正常细胞在向恶性肿瘤细胞演变的过程中,增殖加速、EMT和血管生成激活,这是恶性肿瘤的特征。有报道称,NETs通过激活血管生成,将肿瘤细胞从休眠期转化为增殖期,从而促进肿瘤的进展。为了探讨NETosis与这些恶性特征之间的关系,作者通过z-score算法量化了肿瘤在促进NETs、血管生成、EMT和细胞周期方面的能力。作者发现,NETs的z-score在整个TCGA泛癌队列或大多数肿瘤类型中,与血管生成的z-score(R=0.5369, p<0.0001)、EMT的z-score(R=0.7444, p<0.0001)和细胞周期的z-score(R=0.3835, p<0.0001)之间分别存在显著的正相关。换言之,具有较强促进NETosis潜能的肿瘤,一般在微环境中伴随更活跃的血管生成,肿瘤细胞的侵袭性更强。

为了进一步表征和比较高危患者和低危患者的肿瘤生物学行为和免疫微环境,作者从TCGA数据集中提取了1599例肺腺癌、结肠癌、肾透明细胞癌和三阴性乳腺癌患者的数据。根据各类型肿瘤患者的NETs得分,基于最佳临界值,将肿瘤患者分为高危组和低危组。高危组和低危组之间的差异基因(DEGs)进行GO富集分析,分析表明,差异基因的特征与NETs形成过程的特征一致,如:中性粒细胞活化、中性粒细胞脱粒和中性粒细胞介导的免疫,以及涉及肿瘤转移的环节,如:细胞粘附的正调控、细胞外组织和细胞外基质降解。
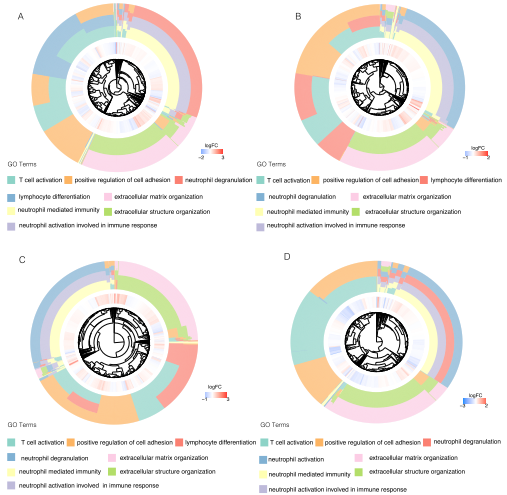
7、NETs相关基因在临床队列中的重现
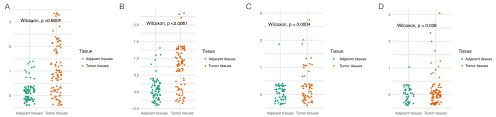
建立NETs评分是为了基于几种转录本的表达水平评估肿瘤的NETosis潜力。为了更好地阐明NETosis与患者预后的关系,作者将两种指示NETs形成的NETosis经典标志物:MPO和H3Cit,进行了IHC验证,结果表明,肾透明细胞癌、肺腺癌、结肠癌的NETs评分与患者预后显著相关,而在三阴性乳腺癌中两者不相关。结果显示,MPO的表达定位主要集中在肿瘤浸润间质细胞的胞浆中,染色强且清晰,而在癌旁组织中较为少见。因此,作者用基质细胞中MPO+细胞的比例评分(MPO评分)来衡量肿瘤组织NETosis的程度。结果显示,MPO评分可以对结肠癌、肾透明细胞癌和肺腺癌患者的预后进行分层,但在三阴性乳腺癌患者中无显著差异。与TCGA队列中乳腺癌相对较低的NETs评分一致,MPO在三阴性乳腺癌中的染色率(7/66)显著低于肺腺癌(14/58)、结肠癌(55/84)和肾透明细胞癌(54/81) (χ2检验,p值均小于0.05)。所有可用的临床指标均纳入了单因素Cox回归分析,如:性别、年龄、TNM分期和病理分型等。有统计学意义的指标纳入后续的多因素Cox回归分析。如以下森林图所示,MPO评分是影响结肠癌和肾透明细胞癌患者预后的独立因素。然而,作者发现在肺腺癌的IHC队列中,MPO评分与TNM分期显著正相关(Kruskal-Wallis检验,p=0.0371),而在多因素Cox模型中,它不是一个独立预后因素。
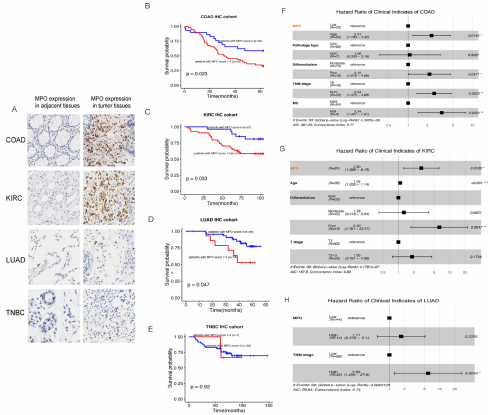
H3Cit被认为是NETosis中的一个重要环节,是NETs的一个特异性标志物。可能是由于H3Cit对指示NETs形成的高特异性,作者的IHC队列中H3Cit的阳性率太低,无法评估(只有8例患者阳性染色)。因此,作者无法基于H3Cit评估NETs形成的预后价值。
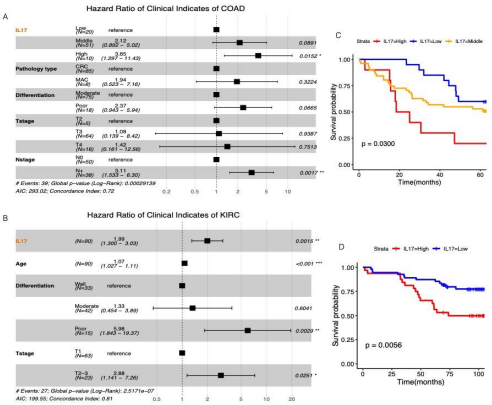
NETs评分模型是一个由多基因组成的评估系统,因此,其中任何一个单独基因的表达水平可能不能直接反映模型的预测能力。例如,IL-17,由IL-17A编码,一直被认为是中性粒细胞的招募者和NETs的启动子,作为促进NETs形成的一个组成部分。最初被纳入了模型构建,但IL-17A在最终模型中系数为负。作者推测这可能与肿瘤组织中IL-17来源广泛有关,使该基因具有复杂的生物学效应。作者的免疫组化结果显示,IL-17在包括肿瘤细胞在内的多种类型的细胞中表达,这与之前的报道一致。在作者的实验队列中,肿瘤组织中IL-17的总体表达水平与患者的临床结果不相关。而肿瘤间质中IL-17+细胞的比例评分(IL-17评分)与MPO评分显著相关(Kruskal-Wallis检验,p=0.0411)。与MPO评分一致,IL-17评分也是结肠癌和肾透明细胞癌患者的独立预后因素,IL-17评分越高,患者的总生存期越短。然而,IL-17评分不是肺腺癌患者的独立预后因素,这可能与上文中MPO评分在肺腺癌队列中并不是一个独立的预后因素相关。IL-17评分和MPO评分的结果表明,IL-17的表达只有在基质细胞中对促进NETosis发挥重要作用。因此,IL-17A等单基因在肿瘤组织中的整体表达水平不足以代表NETs评分模型的结果。
作者应用LASSO Cox模型,通过泛癌数据集建立了NETs评分,评估了原发灶NETosis的形成与患者预后之间的关系。结果表明,肿瘤组织的NETs形成潜能与多种恶性特征高度一致,与泛癌患者的临床结局相关。评估并靶向NETs在肿瘤病变中的形成,可促进肿瘤的个性化治疗。
参考文献
Zhang Y, Guo L, Dai Q, et al. A signature for pan-cancer prognosis based on neutrophil extracellular traps. Journal for ImmunoTherapy of Cancer2022;10:e004210. doi:10.1136/jitc-2021-004210.





