研究背景
肿瘤细胞代谢的一个突出特征是即使在有充足氧气存在的情况下,也能从线粒体氧化磷酸化(OXPHOS)转换为有氧糖酵解。糖酵解的协同上调,被称为Warburg效应,该效应导致能量和中间代谢物的产生,这是激活生物合成途径和肿瘤细胞快速增殖所必需的。越来越多的证据表明,在大多数肿瘤细胞中,Warburg效应的原因不是由于线粒体功能障碍。相反,许多机制,包括致癌基因的激活和抑癌基因的功能缺失突变,都积极促进糖酵解转换。然而,在恶性肿瘤的进展中,是否存在一种携带罕见突变的内在抑制因子来阻止肿瘤从OXPHOS到有氧糖酵解的代谢转换,迄今尚不清楚。
细胞因子样蛋白1 (CYTL1)最初在来源于骨髓和脐带血的人CD34+细胞中被发现。CYTL1蛋白的精确三级结构仍有待确定。生物信息学分析表明,CYTL1在其N端(从氨基酸残基aa1到aa22)有一个信号肽,是一种类似于白介素(IL)-8样趋化因子折叠的分泌蛋白。迄今为止,CYTL1已被证明具有多种生物学功能,如:趋化和促血管生成活性。在人神经母细胞瘤中,在肿瘤组织和细胞系中检测到高水平的CYTL1表达,而cytl1的表达沉默抑制SH-SY5Y神经母细胞瘤细胞的增殖、迁移和侵袭。与该篇CYTL1在某些细胞系中的表达相反,CYTL1被确定为与胃癌良好预后相关的7个基因标签之一。最近的一项研究报道,由于cytl1的高甲基化,在包括乳腺癌在内的大多数肿瘤中都发现了cytl1的表达下调。然而,尚不清楚CYTL1在这些不同的活动中是如何起作用的。这些观察促使作者明确CYTL1在肿瘤进展中的作用。
研究路线
研究内容
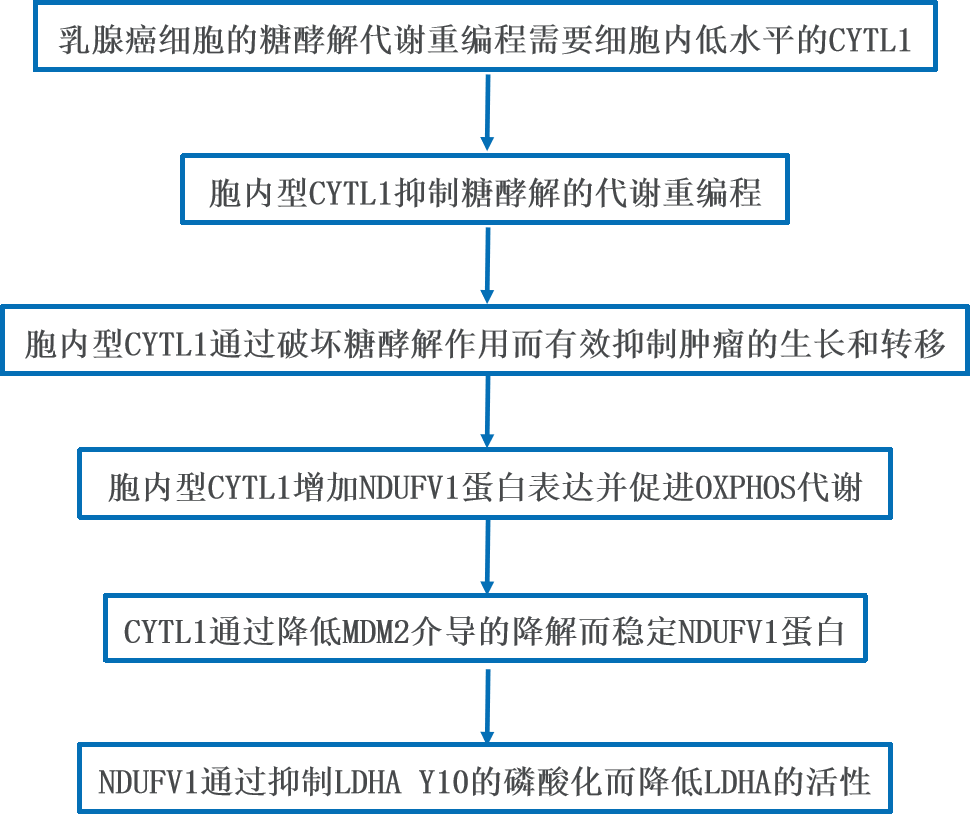
1、乳腺癌细胞的糖酵解代谢重编程需要细胞内低水平的CYTL1
为了研究是否存在与目前已知的不同的新型肿瘤抑制因子,作者首先进行了生物信息学分析。来源于The cancer Genome Atlas (TCGA)数据库的数据分析显示,乳腺癌患者肿瘤组织中cytl1的表达水平明显低于癌旁非肿瘤组织。与正常组织相比,cytl1在四种不同分子亚型乳腺癌中的表达均较低。此外,TCGA数据库分析显示,在乳腺癌进展过程中,cytl1的表达呈下降趋势。免疫组化(IHC)分析证实,CYTL1蛋白表达与乳腺癌恶性程度呈负相关。GEO数据库分析显示,cytl1表达水平较低与乳腺癌远处无转移生存期较差相关。有转移的乳腺癌患者肿瘤组织中cytl1的表达水平明显低于无转移的乳腺癌患者。此外,基于GEO数据库的分析显示,cytl1的低表达与乳腺癌患者较差的总生存期相关。然后作者用IHC评估了80例乳腺癌患者的CYTL1蛋白表达水平与生存率之间的关系,56例CYTL1表达较低的患者与24例CYTL1表达较高的患者相比,总体生存期明显较差。这些结果提示,CYTL1蛋白表达较低与乳腺癌预后不良相关。同时,作者检测结果表明,CYTL1蛋白在不同的乳腺癌细胞株中表达水平不同,除ZR-75-1细胞外,大部分细胞株的CYTL1表达水平较低。
DNA高甲基化可能是乳腺癌中CYTL1低表达的原因,作者评估了DNA甲基化抑制剂:地西他滨对乳腺癌细胞株MDA-MB-231中CYTL1表达的影响。结果表明,地西他滨以时间依赖的方式增加CYTL1的mRNA表达。作为阳性对照,作者测定了启动子甲基化与乳腺癌诱导相关的BRCA1基因表达,发现地西他滨处理后,BRCA1基因表达增加。与BRCA1蛋白水平的显著增加相反,地西他滨处理4天后,细胞裂解液中CYTL1的蛋白水平下降。通过ELISA检测,作者发现在地西他滨处理后,培养上清中CYTL1的数量逐渐增加。这些结果表明,乳腺癌细胞可能通过细胞外释放而降低细胞内CYTL1的水平。
与之前的研究一致,TCGA数据库显示,乳腺癌患者肿瘤组织中cytl1的表达与其甲基化水平呈负相关。但CCLE数据库的乳腺癌细胞系中CYTL1的甲基化水平分析,没有发现相关性。ZR-75-1细胞系中CYTL1蛋白的表达在9个乳腺细胞系中是最高的,但其甲基化水平仍然很高。由于DNA拷贝数对相关基因的表达水平也有重要影响,作者进一步基于CCLE数据库分析了CYTL1拷贝数在乳腺癌细胞系间的差异。大多数乳腺癌细胞系的CYTL1拷贝数都很低。在9个乳腺细胞系中,ZR-75-1细胞的CYTL1拷贝数最高。这些发现支持乳腺癌细胞通过多种方法主动降低CYTL1的mRNA和蛋白水平,以产生CYTL1低表达的细胞内环境。
为了探讨CYTL1调控乳腺癌发展的机制,作者使用从TCGA数据库获得的RNA测序数据进行了转录组分析。基因富集分析显示,在cytl1低表达的乳腺癌患者中,糖酵解基因条目被富集(FDR q=0.019)。鉴于肿瘤通过重组代谢途径来满足恶性细胞的生物能量和生物合成需求,作者研究了CYTL1对有氧糖酵解的影响,该过程的特征是葡萄糖摄取和乳酸生成的增加。CYTL1的过表达导致MDA-MB-231细胞对2-NBD-葡萄糖的摄取减少,而CYTL1的表达缺失导致CYTL1敲除(KO)细胞对2-NBD-葡萄糖的摄取显著增加。CYTL1的过表达以剂量依赖的方式减少2-NBD-葡萄糖的摄取。作者还比较了三种具有代表性的乳腺癌细胞系和其他六种具有不同CYTL1表达水平的细胞系对葡萄糖的摄取。一致的是,葡萄糖摄取活性与CYTL1的表达水平呈负相关。高CYTL1水平的ZR-75-1细胞比低CYTL1水平的MDA-MB-231或BT549细胞具有更低的葡萄糖摄取潜力。此外,在MDA-MB-231细胞中,CYTL1过表达增强了基础耗氧率(OCR),而CYTL1的表达缺失减弱了OCR的增加。细胞外酸化率(ECAR)结果则相反。这三种乳腺癌细胞株也观察到了类似的结果,表明CYTL1可能在乳腺癌细胞中维持OXPHOS状态。乳酸是有氧糖酵解的最终产物。作者发现CYTL1过表达降低了细胞外乳酸的丰度,而shRNA介导的CYTL1表达敲除导致MDA-MB-231细胞中乳酸产量增加。在检测的三种乳腺癌细胞株中,乳酸生产的基线水平也与CYTL1表达水平呈负相关。考虑到CYTL1很少发生突变,作者的研究结果表明,细胞内低水平的CYTL1,而非失去功能的突变,是促进代谢向有氧糖酵解转换所必需的。
2、胞内型CYTL1抑制糖酵解的代谢重编程
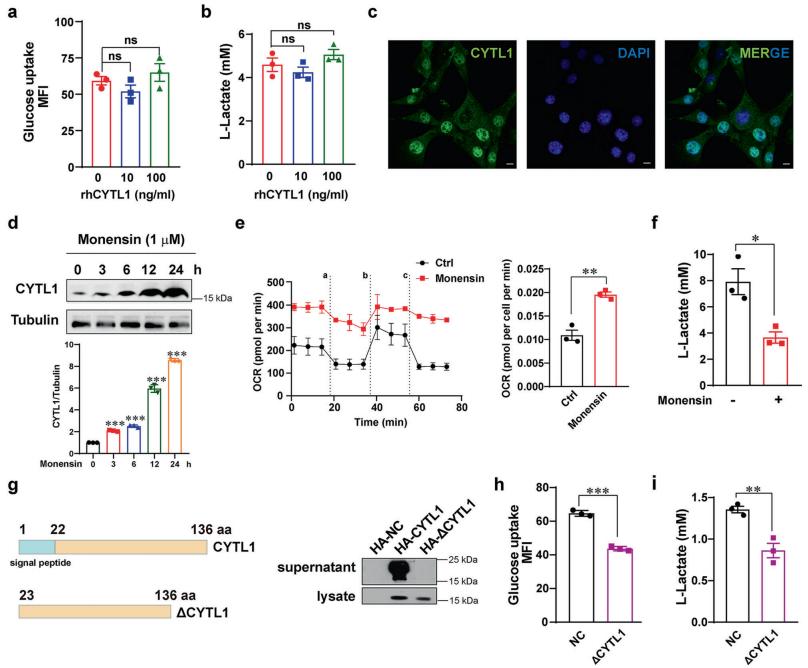
虽然大量的研究关注于CYTL1作为一种分泌蛋白的功能,但CYTL1的低水平mRNA和蛋白表达与乳腺癌的进展和糖酵解的代谢重编程有关,这启发了作者去研究CYTL1在细胞内的作用。作者取消了重组人CYTL1 (rhCYTL1)在糖酵解中的作用。不同浓度的rhCYTL1既不影响MDA-MB-231细胞中葡萄糖的吸收,也不影响乳酸的产生,支持胞内型CYTL1,而非分泌型,调控乳腺癌细胞的代谢。基于从GeneCards数据库(https://www.genecards.org)获得的人类基因信息,作者预测了CYTL1的亚细胞定位,以及细胞外定位。免疫荧光检测表明,CYTL1分布在MDA-MB-231细胞的细胞质和细胞核中。当CYTL1的分泌被monensin(高尔基体介导的蛋白转运抑制剂)阻断时,细胞裂解液中CYTL1的数量在24小时内呈时间依赖性增加。同时,OCR增强,但在24小时后乳酸的产生显著减少。当分析转染的MDA-MB-231细胞中HA标记的全长CYTL1的表达时,上清液中的主要为分子量约20 kDa的形态,这与仅存在于细胞裂解液中的17 kDa形态不同。这一发现与Scheller等人的数据相似,表明存在两种CYTL1形态。为了进一步研究细胞内而非细胞外形态的CYTL1在乳腺癌代谢中的可能作用,作者构建了一个编码ΔCYTL1的质粒,该质粒中缺少CYTL1的1-22 aa信号肽。与全长CYTL1相比,ΔCYTL1约17 kDa大小,但在上清液中没有检测到,表明CYTL1的分泌完全受到抑制。ΔCYTL1异常表达影响了MDA-MB-231细胞的葡萄糖吸收。细胞外乳酸的丰度也随着ΔCYTL1的表达而降低。CCR2已被鉴定为CYTL1的可能受体,调控ERK信号通路。然而,作者并未观察到ΔCYTL1对CCR2B的mRNA表达的影响或对下游ERK信号通路的激活,表明胞内型CYTL1可能具有与分泌型不同的功能。
3、胞内型CYTL1通过破坏糖酵解作用而有效抑制肿瘤的生长和转移
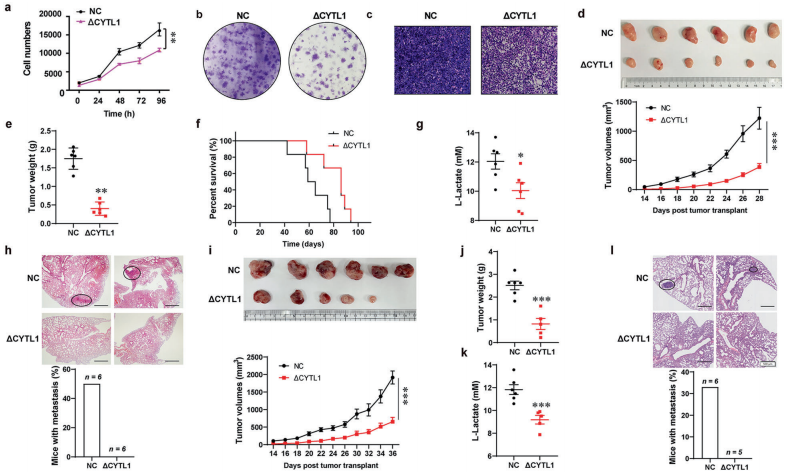
接下来,作者通过靶向糖酵解研究胞内型CYTL1是否能够在体外或体内减缓或抑制乳腺癌细胞的生长或转移。 ΔCYTL1的异常表达显著抑制MDA-MB-231细胞的增殖、集落形成和侵袭,提示有氧糖酵解与肿瘤细胞生长呈正相关。然后将稳定表达ΔCYTL1的MDA-MB-231细胞接种到雌性裸鼠乳腺脂肪垫中,建立原位移植模型。与对照组相比,由ΔCYTL1转染细胞形成的肿瘤生长明显缓慢。植入28天后,与对照组相比,由ΔCYTL1转染细胞形成的肿瘤重量减少了约3倍,小鼠的总生存期延长。为了评估胞内型CYTL1的表达对体内有氧糖酵解的影响,作者测量了小鼠的血清乳酸水平,这可以表征糖酵解状态。表达ΔCYTL1肿瘤的小鼠血清乳酸水平低于对照组,提示其糖酵解率较低。HE染色显示,接种表达ΔCYTL1的MDA-MB-231细胞28天后,肺转移率未见变化,而对照组的转移率增加了50%。同样,免疫功能良好的小鼠接种稳定表达ΔCYTL1的E0771小鼠乳腺腺癌细胞后,也观察到肿瘤抑制。与上述结果一致的是,表达ΔCYTL1的肿瘤细胞的小鼠血清乳酸水平要低得多。此外,HE染色显示,在接种表达ΔCYTL1的E0771细胞36天后,肺转移率未见增加,而对照组的转移率增加了33%以上。与对照肿瘤相比,ΔCYTL1转染细胞形成的肿瘤中巨噬细胞的百分比并没有显著增加,说明ΔCYTL1对小鼠巨噬细胞没有趋化作用。当检测肿瘤组织中血管生成相关基因的表达时,免疫荧光显示,与对照肿瘤相比,ΔCYTL1转染细胞形成的肿瘤中CD31+血管明显减少,提示ΔCYTL1抑制血管生成,且与转移密切相关。由于糖酵解参与STAT3活性的正反馈调节,作者检测了CYTL1对STAT3磷酸化的影响。与之前的研究一致,CYTL1和ΔCYTL1的异常表达降低了p-STAT3(Y705)的水平。这些结果表明,胞内型CYTL1可能通过抑制糖酵解而发挥抑瘤作用。
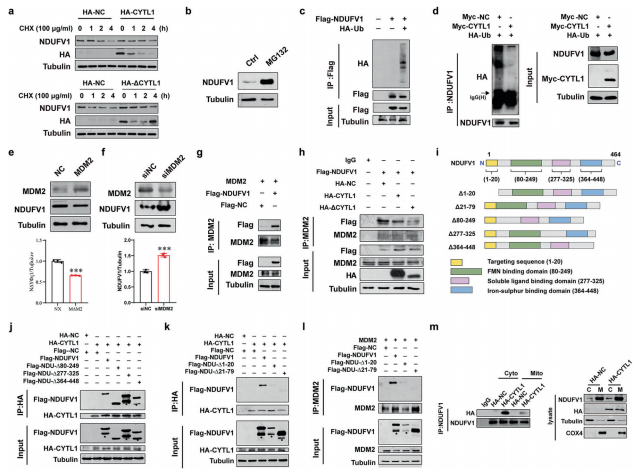
4、胞内型CYTL1增加NDUFV1蛋白表达并促进OXPHOS代谢
为了阐明胞内型CYTL1调控乳腺癌细胞OXPHOS和有氧糖酵解之间的代谢转换的机制,作者检测了CYTL1对丙酮酸生成的影响,丙酮酸是糖酵解途径的关键代谢物,对乳酸的形成至关重要。与对照细胞相比,稳定表达CYTL1或ΔCYTL1的MDA-MB-231细胞的丙酮酸含量没有变化。相反,这两种形式的CYTL1的异常表达增加了ATP和NAD+的产生,提示细胞内CYTL1可能通过线粒体电子传递链中的复合物I促进了NADH向NAD+的氧化。使用IACS-010759作为阳性对照,作者并未检测到rhCYTL1对复合物I活性的直接影响。然后作者进行了pull-down实验,并结合质谱分析来鉴定与CYTL1相互作用的蛋白。NDUFV1是198个差异相互作用蛋白中的一个候选蛋白。HEK293T细胞的co-IP分析显示,HA标记的CYTL1和ΔCYTL1与Flag标记的NDUFV1相互作用。而且,内源性NDUFV1与HA-CYTL1和HA-ΔCYTL1相互作用。免疫荧光证实,HA-CYTL1与NDUFV1共定位。此外,CYTL1过表达或缺失时,NDUFV1蛋白水平的变化证明,CYTL1正向调控NDUFV1蛋白的表达。然而,rhCYTL1对NDUFV1蛋白表达没有影响,因此排除了胞外CYTL1的作用。NDUFV1的mRNA水平不受CYTL1丰度的影响,排除了CYTL1影响NDUFV1转录的可能性。另外,在三种乳腺癌细胞系中,CYTL1的丰度与NDUFV1蛋白水平呈正相关。此外,NDUFV1的表达沉默逆转了MDA-MB-231细胞中CYTL1或ΔCYTL1过表达引起的乳酸生成的减少,表明CYTL1依赖于NDUFV1,通过抑制糖酵解来维持代谢稳态。同样,NDUFV1的过表达减少了葡萄糖摄取并增加了OCR。
接下来,作者使用环己酰亚胺(CHX,蛋白质合成抑制剂)处理稳定表达HA标记CYTL1或ΔCYTL1的MDA-MB-231细胞,检测NDUFV1蛋白的降解情况。 在CHX处理的对照组细胞中,NDUFV1蛋白在4小时内迅速降解,但CYTL1和ΔCYTL1的异常表达延缓了NDUFV1的降解。蛋白酶体抑制剂MG132处理MDA-MB-231细胞后,NDUFV1蛋白水平增加。 Co-IP分析证实了NDUFV1和泛素(Ub)之间的相互作用。 这种相互作用在CYTL1异常表达的细胞中被阻断。 这些结果表明,NDUFV1蛋白以依赖CYTL1的方式受到保护,可以不被Ub-蛋白酶体系统降解。
MDM2是E3泛素连接酶,在乳腺癌在内的多种癌症中过表达。为了验证MDM2调控NDUFV1泛素化的可能性,作者检测了MDM2表达对NDUFV1蛋白水平的影响。MDM2的过表达降低了NDUFV1的蛋白水平,而siRNA介导的MDM2表达敲除则产生相反的效果。使用外源性MDM2从HEK293T细胞中免疫纯化后,以带有Flag标记的NDUFV1为探针,检测到MDM2-NDUFV1相互作用,该作用可以被CYTL1或ΔCYTL1的过表达部分阻断,表明CYTL1可能通过竞争性结合而阻断MDM2介导的NDUFV1降解。作者用NDUFV1的截断版本转染HEK293T细胞。虽然NDUFV1三个预测功能结构域(FMN结合域、可溶性配体结合域和铁硫结合域)的缺失对NDUFV1与CYTL1的相互作用没有影响,但NDUFV1结合CYTL1和MDM2都需要1-20 aa结构域(线粒体定位序列)和21-79 aa结构域。MDM2介导的蛋白酶体降解经常发生在细胞质内。作者注意到胞质中NDUFV1和CYTL1之间存在优先相互作用。这些结果表明,细胞内CYTL1竞争性地结合NDUFV1,以阻止其在细胞质中被MDM2介导的泛素化降解。
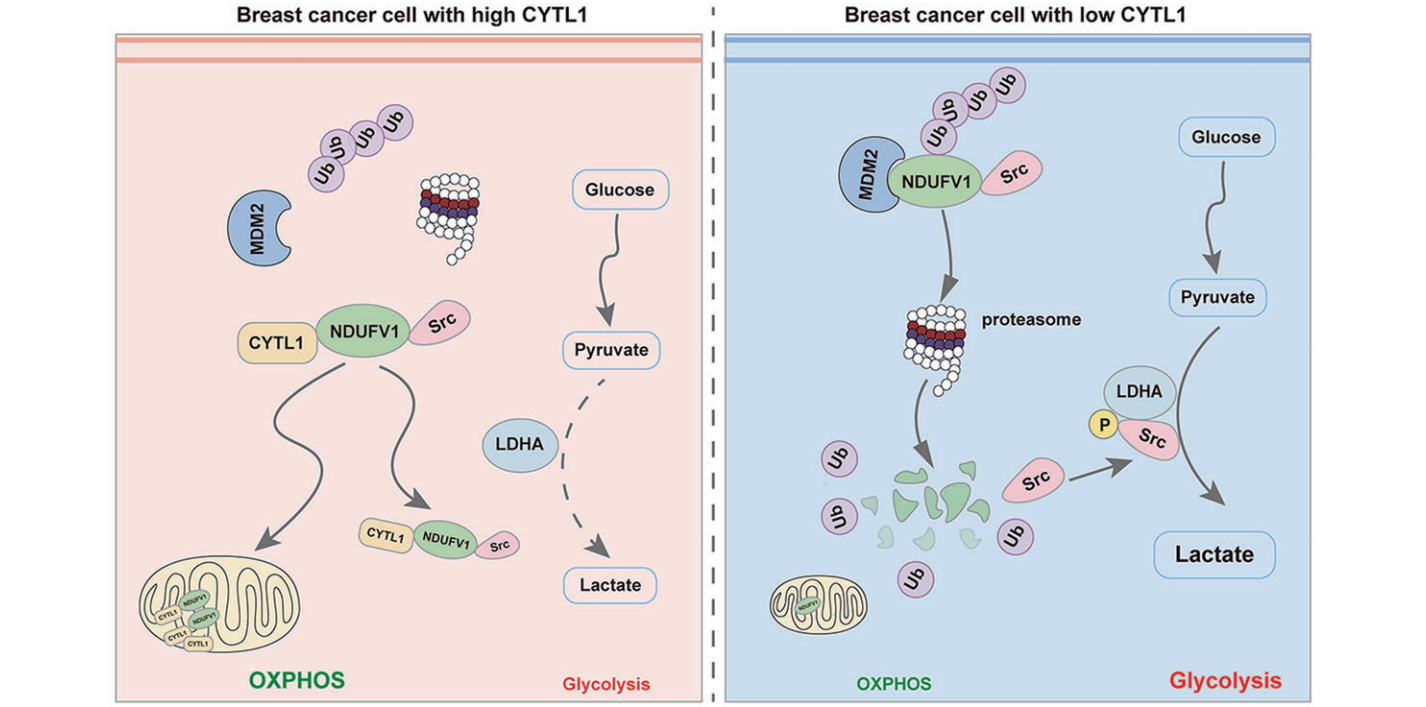
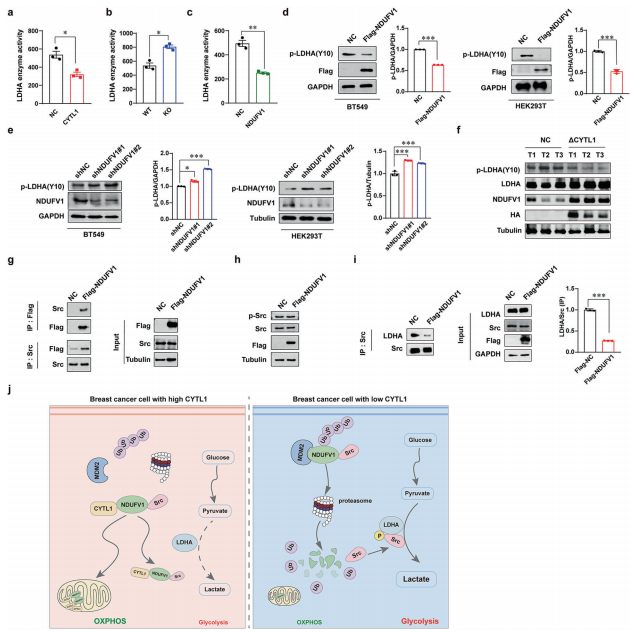
LDHA是糖酵解中的一种关键代谢酶,可催化丙酮酸和乳酸的相互转化,促进肿瘤进展。鉴于CYTL1过表达的乳腺癌细胞乳酸产生的显著减少,作者研究了细胞内CYTL1是否通过稳定NDUFV1而影响LDHA酶活性。检测表明,CYTL1表达丰度与LDHA活性呈负相关。同样,NDUFV1的过表达也抑制了LDHA的活性。然而,LDHA的蛋白表达水平不受CYTL1、ΔCYTL1或NDUFV1丰度的影响。由于LDHA活性通常归因于其酪氨酸10的磷酸化,作者接下来研究了NDUFV1对LDHA磷酸化的影响。NDUFV1的过表达抑制了BT549和HEK293T细胞中LDHA Y10的磷酸化,而NDUFV1的下调则产生相反的效果。原位乳腺癌模型中,在表达ΔCYTL1的肿瘤组织中检测到LDHA Y10磷酸化水平的显著降低。然后作者进行了pull-down实验,并结合质谱鉴定与NDUFV1相互作用的蛋白。Src是449个差异相互作用蛋白中的一个候选蛋白。之前的一项研究报道,Src使乳腺癌中的LDHA酪氨酸10磷酸化。CYTL1或NDUFV1的shRNA干扰导致MDA-MB-231细胞中乳酸产量显著增加,而KX2-391(Src激酶抑制剂)完全逆转了这一趋势。作者的co-IP分析进一步证实,Flag标记的NDUFV1与内源性Src相互作用。值得注意的是,NDUFV1的过表达对Src磷酸化没有影响,这表明NDUFV1不能使Src激活。另一项co-IP分析显示,NDUFV1干扰了Src与LDHA的结合。这些结果表明,NDUFV1可以与Src相互作用,抑制LDHA磷酸化。综上所述,细胞内CYTL1可能是一种新的肿瘤抑制因子。它通过使受MDM2介导的蛋白酶体系统降解的NDUFV1稳定,促进向OXPHOS的代谢转换,并能够与Src相互作用抑制LDHA活性。在CYTL1表达水平低的乳腺癌中,肿瘤代谢重编程从OXPHOS转换为糖酵解。


在本研究中,作者首次证明CYTL1可能是一种新型的肿瘤抑制因子,能够阻断从OXPHOS到糖酵解的代谢转换。在代谢重编程过程中,肿瘤细胞主动降低了细胞内CYTL1的水平,以产生CYTL1低表达的细胞内环境,这与乳腺癌患者的恶性进展相关。
机制上,胞内型CYTL1可与MDM2竞争性结合NDUFV1,从而干扰NDUFV1的泛素化降解,稳定NDUFV1的蛋白水平,实现稳态的OXPHOS代谢。同时,NDUFV1可与Src相互作用抑制LDHA的活性,抑制有氧糖酵解。
作者的研究揭示了CYTL1作为一种内在的肿瘤抑制因子,在肿瘤中维持代谢稳态的功能,这有助于为癌症的治疗干预提供潜在的切入点。因此,调节细胞内CYTL1的表达及其对NDUFV1蛋白的稳定可能是乳腺癌治疗的一种新策略。
参考文献
Xue, W., Li, X., Li, W. et al. Intracellular CYTL1, a novel tumor suppressor, stabilizes NDUFV1 to inhibit metabolic reprogramming in breast cancer. Sig Transduct Target Ther 7, 35 (2022). https://doi.org/10.1038/s41392-021-00856-1





