乳腺癌是全球范围内威胁妇女健康的最常见的肿瘤之一。雌激素受体α (ERα)在大约70%的乳腺癌中表达,说明了该受体和肿瘤进展相关。靶向ERα信号转导的治疗方法,如选择性ERα调节剂、选择性ER降解剂和芳香化酶抑制剂,已被广泛用于ERα过表达乳腺癌患者的治疗。然而,尽管其疗效被大众认可,但随着时间的推移,一些患者会出现耐药,内分泌疗法往往失去其效力。因此,研究ERα信号通路在乳腺癌中的作用机制仍是十分必要的。
许多因子参与调控ERα的表达和活性,BMP/SMAD/RUNX2轴与多种ER的调控机制有关。通过雌激素增强,BMP(骨形态发生蛋白)配体与I型和II型两种不同的丝氨酸/苏氨酸激酶受体(BMPR1A和BMPR1B)结合,并调节SMAD的激活,导致SMAD4和RUNX2的表达增加。RUNX2作为一种转录因子,通过调控下游基因的转录,与乳腺癌进展的多个阶段有关。最新研究报道,RUNX2参与雌激素信号通路在内的多个重要信号通路。RUNX2增强芳香化酶的表达,使雌激素水平升高,最终导致ERα上调。此外,ERα的基因启动子区有一个RUNX2结合位点。因此,BMP/SMAD/RUNX2轴以多种方式与ERα相互作用。
糖基化在蛋白质和脂类的翻译后修饰中起着关键作用,它通常调节生物分子的稳定性和活性。O-GalNAc糖基化是GALNTs催化的最重要糖基化类型。该家族催化O-糖链形成过程中的第一步反应,即将GalNAc转移到多肽链的Ser/Thr残基上。最近的研究表明,这些O-聚糖与多种分泌蛋白和一些膜受体结合。因此,O-GalNAc糖基化可能参与了细胞间通讯、细胞迁移、信号转导和免疫监测等多个生物学过程,其改变可能是多种肿瘤的重要因素。迄今为止,在人类细胞中共有20多个GALNT家族成员被确认,分布在特定的组织类型中。据报道,这些同工酶参与了肿瘤的增殖和迁移。例如,在乳腺癌发展过程中,GALNT6在MUC1的O-GalNAcylation中发挥重要作用;GALNT2已经被证实通过调节EGFR的O-糖基化而增强口腔鳞状细胞癌的侵袭能力;GALNT3在胃癌和结直肠癌中的表达与肿瘤的分化有关。与这些GALNTs不同,GALNT8和其他Y亚家族成员在体外未被观察到具有催化活性。而且,GALNT8只存在于脊椎动物中,这意味着GALNT8可能具有特殊的生物学功能。前期研究表明,GALNT8突变与人类肿瘤、丙型肝炎和高钙血症-高磷血症有关。然而,GALNT8在乳腺癌中的作用尚不清楚。
研究路线
研究内容
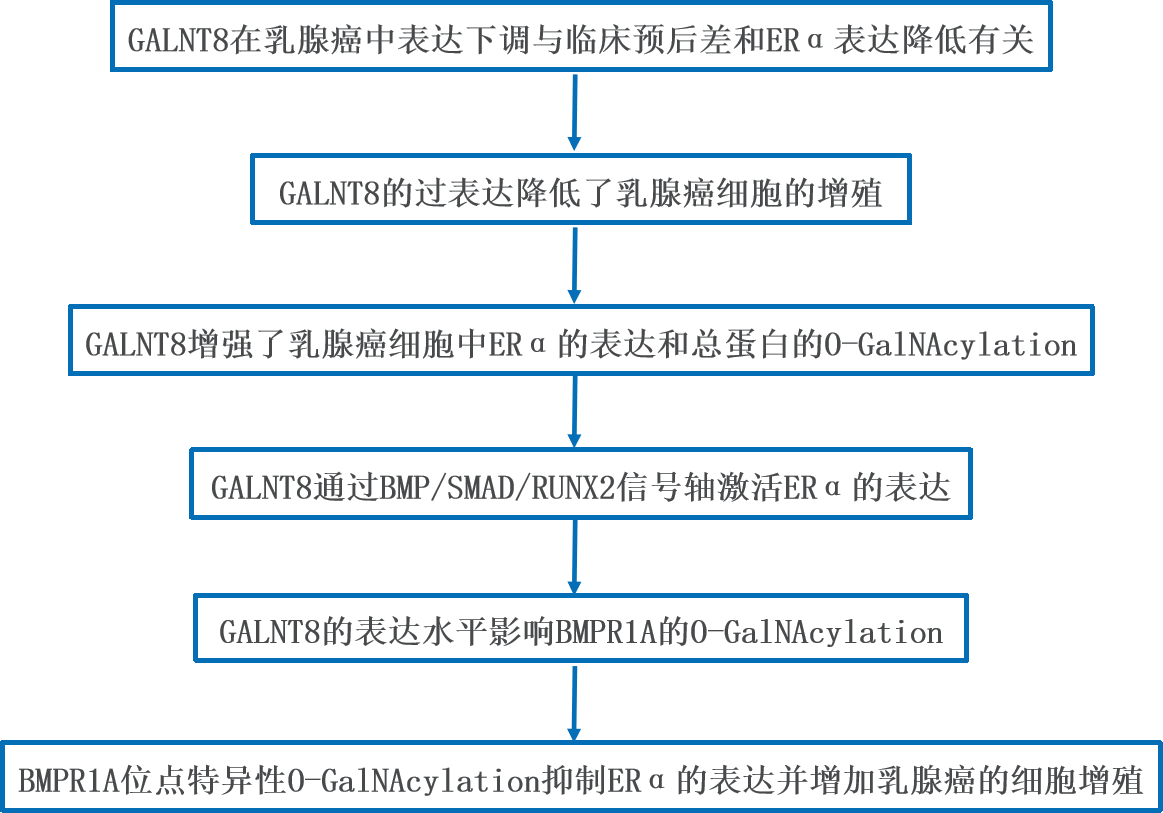
1、GALNT8在乳腺癌中表达下调与临床预后差和ERα表达降低有关
作者用Kaplan-Meier分析了GALNT8的表达对无复发生存率的影响。分析表明,GALNT8高表达预示着乳腺癌患者的无复发生存率增长。利用GEO数据集,作者分析了不同类型乳腺癌患者(GSE70905、GSE70947和GSE72653)的肿瘤和配对癌旁组织的mRNA表达谱。结果表明,GALNT8在乳腺癌组织中的表达明显低于癌旁组织(p<0.05)。接下来,用同样的方法评估了GALNT8在三个GEO数据集(GSE2034, GSE5327和GSE45255)中的表达。结果显示,与ER高表达组织相比,GALNT8在ER低表达组织中的表达水平显著降低(p<0.05)。
为了进一步研究GALNT8与ERα的相关性,作者在含140个人乳腺癌组织的组织芯片中分析了GALNT8的表达。免疫组化的结果显示,在ERα高染色组中,GALNT8表达评分更高。综上所述,这些结果证实了GALNT8的表达下调与乳腺癌中较差的临床结果和较低的ERα表达相关。
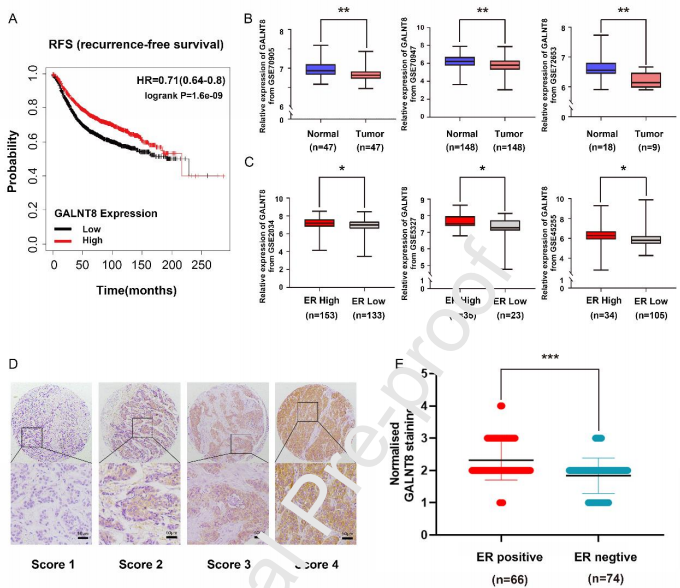
2、GALNT8的过表达降低了乳腺癌细胞的增殖
通常认为,在肿瘤增殖过程中,乳腺癌细胞中的O-GalNAcylation发生许多改变,并伴有多种GALNT的表达改变。然而,GALNT8的功能尚不清楚。作者选择了5种具有代表性的人乳腺癌细胞系,包括ERα阳性或ERα阴性的细胞系,检测了GALNT8的表达。在ERα阳性细胞株:MCF7和T47D中,GALNT8的表达明显高于ERα阴性细胞株,提示GALNT8和ERα可能通过同一通路相互作用。特别的是,GALNT8的检测分子量(95 kD)远高于理论分子量(70 kD)。UniProt数据库显示,GALNT8有3个N-GlcNAc位点(N85, N107和N160),这增加了GALNT8的分子量。作者选择ERα阳性的MCF7细胞和ERα阴性的MDA-MB-231细胞进行后续分析。作者通过qPCR和免疫荧光检测了GALNT8在MDA-MB-231和MCF7细胞中的表达水平。此外,作者通过VVL和PNA凝集素分析了T抗原和Tn抗原。分析表明,T抗原和Tn抗原(总蛋白O-GalNAcylation)在MCF7细胞中的表达均明显高于MDA-MB-231细胞。然而,考虑到其他GALNT亚型的影响,MDA-MB-231与MCF7细胞之间O-GalNAcylation的差异并不能直接影响GALNT8的表达。综上所述,这些结果表明,在ER阳性的乳腺癌细胞MCF7中,GALNT8的表达水平和总蛋白的O-GalNAcylation远高于ER阴性的MDA-MB-231细胞。为了进一步研究GALNT8在乳腺癌细胞中的作用,作者在MDA-MB-231细胞中过表达GALNT8 (MDA-MB-231/T8),并在MCF7细胞中通过两个特异性shRNA (MCF7/shT8-1、MCF7/shT8-2)稳定敲除GALNT8。通过MTT实验来检测GALNT8是否参与细胞增殖,结果显示,GALNT8的过表达极大地抑制了MDA-MB-231的生长速率,而GALNT8的表达沉默可显著增强MCF7/shT8-2细胞的增殖。为了进一步证实GALNT8的过表达所诱导的细胞增殖抑制依赖于ER信号的调控,作者用ER抑制剂Fulvestrant重复了MTT实验。结果表明,GALNT8的表达上调使乳腺癌细胞对Fulvestrant敏感,并通过ER信号通路降低了细胞活力。克隆形成实验的结果表明,GALNT8具有致瘤性。与对照组相比,GALNT8的稳定上调显著抑制了MDA-MB-231细胞的生长速度。相反,在GALNT8敲低后,MCF7细胞的克隆形成频率增加。此外,作者使用VVL和PNA进行免疫荧光实验,结果表明,GALNT8可以影响乳腺癌细胞总蛋白O-GalNAcylation水平。
此外,与对照MDA-MB-231细胞相比,MDA-MB-231/T8细胞中Cyclin (Cyclin A2, Cyclin D1, Cyclin E2)和其他细胞周期相关蛋白如p-Rb和Cdc2的表达显著降低,而在MDA-MB-231/T8细胞中,细胞周期蛋白依赖性激酶抑制蛋白:p57和p27的表达显著上调。相比之下,MCF7/shT8-2细胞中Cyclin A2、CyclinD1、CyclinE2、p-Rb和Cdc2水平显著升高,而p57和p27水平降低。综上所述,GALNT8具有抑制乳腺癌细胞增殖和克隆形成的作用。
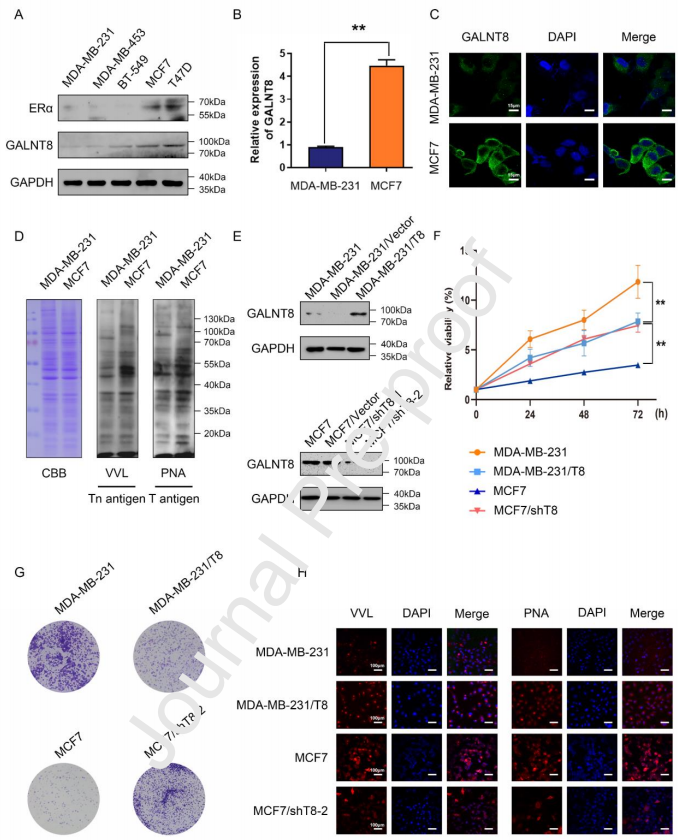
3、GALNT8增强了乳腺癌细胞中ERα的表达和总蛋白的O-GalNAcylation
作者通过调控GALNT8在乳腺癌细胞中的表达,进一步研究了ERα与GALNT8的关系。结果显示,ERα在GALNT8过表达的MDA-MB-231细胞中表达显著上调。瞬时转染shGALNT-2 (MDA-MB-231/T8/shT8-2)48小时后, GALNT8和ERα的蛋白表达水平同时降低。然而,GALNT8在MCF7/shT8-2细胞中表达恢复时,ERα的表达增加。由于GALNT8调控O-GalNAcylation的第一步,并导致T抗原和Tn抗原的形成,作者接下来检测了T抗原和Tn抗原在GALNT8过表达的MDA-MB-231细胞中的表达。Lectin blot检测显示,MDA-MB-231/T8细胞中T抗原和Tn抗原的表达明显增加。相反,MCF7/shT8-2细胞中的T抗原和Tn抗原表达显著降低,而 GALNT8表达恢复的细胞(MCF7/shT8-2/T8)的T抗原和Tn抗原表达恢复。因此,这些结果提示,GALNT8参与了影响ERα表达活性和总蛋白O-GalNAcylation的途径。

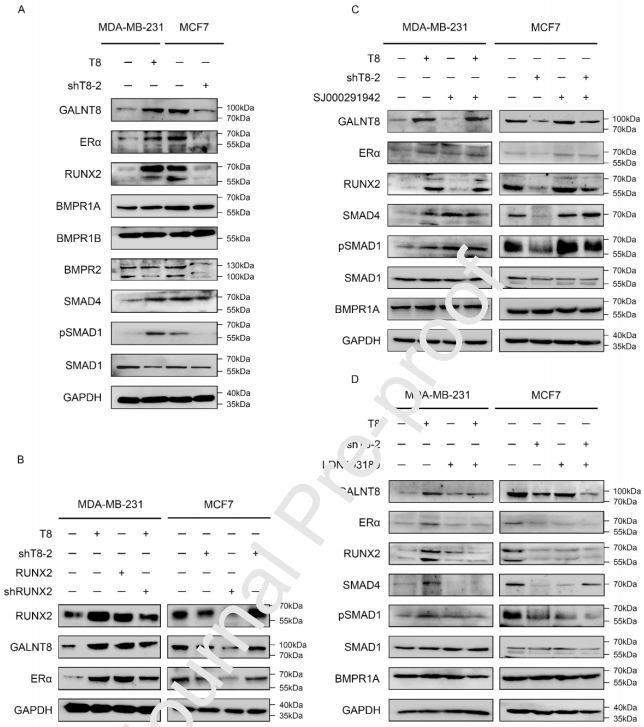
4、GALNT8通过BMP/SMAD/RUNX2信号轴激活ERα的表达
基于这些发现,作者研究了GALNT8在乳腺癌细胞中影响ERα表达的机制。前期研究表明,ERα的表达受到BMP/SMAD/RUNX2信号轴的密切调控。有趣的是,BMPR1A作为BMP/SMAD通路的关键因子,已在体外被证明为GALNT14的底物。本文,作者集中研究了GALNT8和BMPR1A之间的关系。作者首先分析了RUNX2、BMPRs和SMADs在乳腺癌细胞中的组成性表达。结果显示,MDA-MB-231/T8细胞和MCF7细胞中RUNX2和SMAD4水平分别显著高于MDA-MB-231和MCF7/shT8-2细胞。这一趋势与ERα的表达水平一致。此外,MDA-MB-231和MCF7/shT8-2细胞中SMAD1磷酸化水平(pSMAD1)下调。这些结果提示,GALNT8和BMP/SMAD/RUNX2信号通路共同调控ERα的表达。为了进一步确定RUNX2是否参与了这一调控,作者分别将RUNX2 shRNA(shRUNX2)和人RUNX2全长表达载体转染入MCF7和MDA-MB-231细胞。RUNX2和GALNT8的过表达导致ERα表达水平升高。与这些观察结果相反,RUNX2和GALNT8的表达敲除导致ERα表达水平下降。作者在MDA-MB-231/T8细胞中将RUNX2的表达下调。结果表明,shRUNX2降低了ERα的蛋白水平。另一方面,在MCF7/shT8-2细胞中过表达RUNX2可恢复ERα蛋白水平。此外,为了明确GALNT8与RUNX2谁为调控的上游,作者通过qPCR检测了MDA-MB-231和MDA-MB-231/T8细胞中的RUNX2的mRNA表达水平,在MDA-MB-231和过表达RUNX2的MDA-MB-231 (MDA-MB-231/RUNX2)细胞中检测了GALNT8 的mRNA表达水平。结果显示,过表达GALNT8可显著提高RUNX2的mRNA水平,说明GALNT8位于RUNX2的上游。因此,作者推断GALNT8通过激活RUNX2而促进ERα的表达。
为了进一步证明GALNT8对BMP/SMAD/RUNX2信号轴的影响,作者分别用BMP/SMAD激活剂SJ000291942和抑制剂LDN193189处理乳腺癌细胞。结果表明,SJ000291942促进了BMP/SMAD通路,该通路同样被GALNT8的上调激活。有趣的是,SJ000291942显著缓解了GALNT8下调引起的BMP通路抑制,表明GALNT8下调改变了BMP通路。同时,BMP信号通路抑制剂LDN193189使BMP/SMAD通路显著失活,而GALNT8过表达无法激活BMP/SMAD通路。这些结果表明,GALNT8通过BMP/SMAD信号通路调控RUNX2。
5、GALNT8的表达水平影响BMPR1A的O-GalNAcylation
在发现GALNT8的表达增加导致BMP信号通路的激活后,作者进一步研究了BMPR1A在这一调控中的作用。为此,作者在乳腺癌细胞中使用VVL凝集素进行下拉实验,以检测BMPR1A是否被O-糖基化。作者观察到在GALNT8高表达的MDA-MB-231/T8和MCF7细胞中,BMPR1A的O-GalNAcylation显著增加;在MDA-MB-231和MCF7/shT8-2细胞中,BMPR1A的O-GalNAcylation显著降低,并伴有GALNT8的表达降低。这些结果表明,BMPR1A的O-GalNAcylation可能受到GALNT8表达的影响。
为了进一步研究GALNT8与BMPR1A的关系,作者用质粒转染MCF7/shT8-2细胞,该质粒能表达Flag-tagged GALNT8 (T8-M1)的位点突变(DXH box (H280D)和潜在的UDP-GalNAc结合位点(D221Q)。这些突变位点是根据GALNT1 (H211和D156)的保守催化结构域选择的。通过VVL凝集素的IP实验分析BMPR1A的O-GalNAcylation水平。结果表明,与野生型Flag-tagged GALNT8相比,在构建GALNT8双位点突变后,BMPR1A的O-GalNAcylation水平显著下调。在MDA-MB-231和HEK-293T细胞中也得到了类似的结果。此外,co-IP检测证实,BMPR1A可以与乳腺癌细胞中的野生型和突变型GALNT8相互作用。双位点突变导致GALNT8/BMPR1A二聚体消失,提示GALNT8在调节BMPR1A功能中发挥作用。然而,作者仍然不能排除GALNT8间接调控BMPR1A的O-GalNAcylation的可能性。
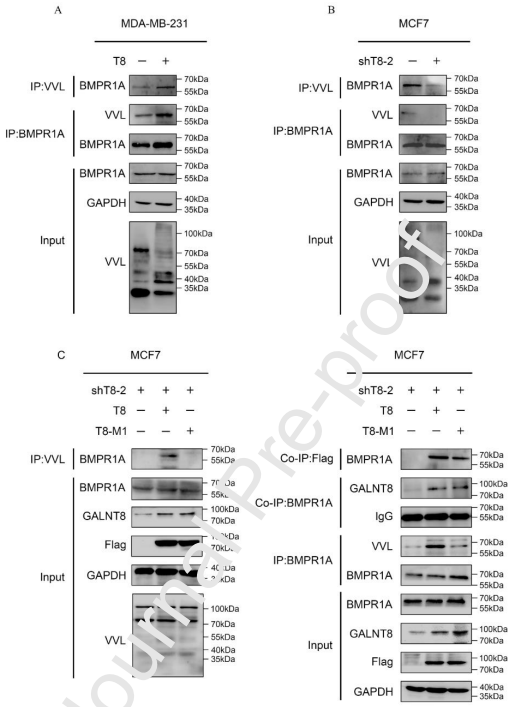
6、BMPR1A位点特异性O-GalNAcylation抑制ERα的表达并增加乳腺癌的细胞增殖
为了进一步证实BMPR1A的O-糖基化位点,作者在BMPR1A内源性稳定敲除的MCF7细胞(MCF7/shBMPR1A)中表达了带HA标签的野生型BMPR1A和位点突变的BMPR1A (Thr137突变为Ala(T137A, M1-HA)和Ser37/Ser39/Ser44/Thr49突变为Ala(S37A/S39A/S44A/T49A, M2-HA))。这些突变位点是根据CBS预测服务器数据库的分析结果选定的。作者通过IP实验获得了带HA标签的蛋白,并分析了它们的O-GalNAcylation水平,研究了它们的活性如何影响下游信号传导。Co-IP实验证实,BMPR1A位点突变不会改变BMPR1A与GALNT8的相互作用。VVL的lectin blot检测表明,与诱导野生型BMPR1A相比,T137A和S37A/S39A/S44A/T49A的替换的O-GalNAcylation的在MCF7细胞中的效率要低得多。此外,无论是M1-HA还是M2-HA的修复都下调了pSMAD1和SMAD4的表达水平,但并未下调SMAD1的总表达水平,这与MCF7细胞中GALNT8表达降低的结果一致。
克隆形成和MTT分析显示,挽救野生型BMPR1A的表达显著抑制MCF7细胞增殖,但这种作用在表达BMPR1A的O-GalNAcylation位点突变时被极大地抑制。综上所述,GALNT8的表达和BMPR1A的O-GalNAcylation可提高ERα的表达,激活BMP/SMAD/RUNX2信号通路,从而抑制乳腺癌细胞增殖。

作者发现并阐明了GALNT8在调控乳腺癌疾病发展中的作用和机制,GALNT8可能成为乳腺癌治疗的潜在靶点。机制上,GALNT8的高表达和BMPR1A的O-GalNAcylation通过调控BMP/SMAD/RUNX2信号通路而增加ERα的表达,进而抑制乳腺癌的细胞增殖。
参考文献
Huang T, Wu Q, Huang H, et al. Expression of GALNT8 and O-glycosylation of BMP receptor 1A suppress breast cancer cell proliferation by upregulating ERα levels[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2021: 130046.





