肝癌是世界上第五大癌症种类,每年有超过50万的新发病例。由于预后不良,肝癌是癌症相关死亡的一个重要原因,每年约有695,900例患者死亡。90%以上的肝癌是在慢性肝炎的基础上发展起来的,主要原因是乙型肝炎病毒(HBV)或丙型肝炎病毒(HCV)感染。肝癌早期通常无明显症状,近85%的患者在确诊时已处于中晚期。
甲胎蛋白(AFP)是一种糖蛋白,是临床上最常用的肝癌诊断血清标志物,广泛应用于肝癌的筛查、诊断、疗效评估和复发评估。许多研究表明,AFP是一个重要的细胞内信号分子,参与多种细胞进程,是一种促癌因子。研究报道,AFP与PTEN的相互作用阻断了PTEN对PI3K/AKT通路的抑制作用,导致肝癌细胞异常增殖;AFP与caspase-3相互作用可阻断caspase-3信号通路,从而抑制凋亡信号通路。AFP还可以通过增加细胞迁移相关基因,如:K19、EpCAM、MMP2/9和CXCR4的表达,促进肝癌细胞的迁移和侵袭。这些研究表明,AFP干扰正常信号网络,并通过与不同的信号蛋白结合而导致肿瘤发生。AFP异常高表达与肝癌的发生发展密切相关,但其在肝癌细胞中转录调控机制以及异常激活机制尚不清楚。
转录因子HBP1属于高迁移率族蛋白超家族(HMG),具有肿瘤抑制作用。HBP1作为一种转录因子,通过直接与特定的亲和元件结合而抑制靶基因,如N-MYC、C-MYC、p47phox、DNMT1、EZH2等,这些都是致癌基因或促进肿瘤发展的基因。HBP1还转录激活多个下游基因,包括编码p16、p21、MPO和组蛋白H1的基因。此外,HBP1蛋白的多个氨基酸残基具有不同的化学修饰,HBP1可以被p38和Pim-1磷酸化,被p300/CBP乙酰化,而GID/CTLH和MDM2可以泛素化HBP1。修饰的类型和位置影响到HBP1的蛋白稳定性和转录活性。由于HBP1参与调控了许多重要的细胞周期调节因子,因此HBP1在细胞或组织中的表达水平可以影响细胞生长或肿瘤发生。
研究路线
研究内容
1、HBP1调控AFP的表达
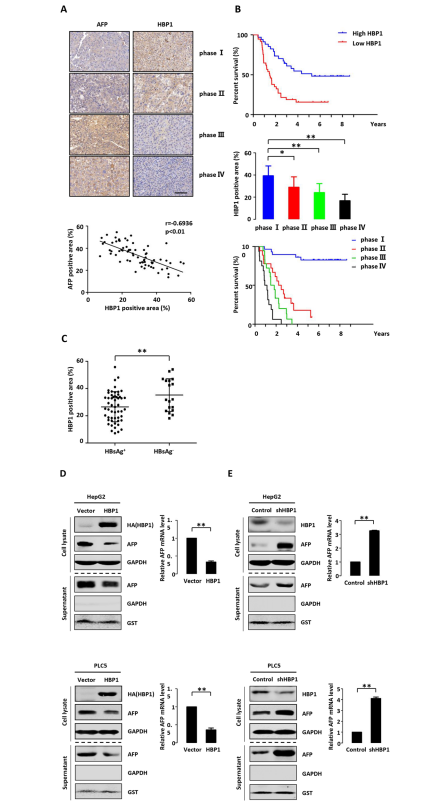
作者对71名肝癌患者(组织芯片)进行了免疫组化染色和生存分析,这些患者均接受保守手术,并随访长达10年。结果表明,肝癌组织中HBP1和AFP的蛋白表达水平呈显著负相关。随着恶性程度的增加,HBP1的表达从TNM分期的I-IV期呈逐渐下降趋势,而AFP的表达从TNM分期的I-IV期呈逐渐增强的趋势。作者将HBP1或AFP的表达量大于均值的患者定义为HBP1或AFP的高表达组,反之为低表达组。生存分析表明,HBP1的高表达或AFP的低表达与较高的生存率相关。HBP1的表达水平随着肿瘤TNM分期的增加而降低,术后生存率也随之降低。此外,HBV阳性(HBs Ag+)肝癌患者的HBP1蛋白表达水平低于HBV阴性(HBs Ag−)肝癌患者。这些数据表明,HBP1和AFP的表达趋势相反与肝癌患者的复发和生存相关。HBP1可能是HBV相关肝癌进展的抑制剂。
为了确定HBP1是否抑制了AFP的表达,作者在HepG2和PLC5细胞中将HBP1过表达。在HepG2和PLC5细胞中,HBP1的过表达均可降低AFP的蛋白(细胞质或培养上清)和mRNA的表达水平。为了证实HBP1对AFP表达的内源性调节作用,作者使用shRNAs敲除了HBP1的表达。结果表明,HBP1的敲除导致两种细胞系中AFP蛋白(细胞质或培养上清)和mRNA表达水平的升高。这些结果表明,HBP1抑制了AFP转录水平的表达。
2、HBP1通过结合AFP启动子中的亲和性位点而抑制AFP基因的表达
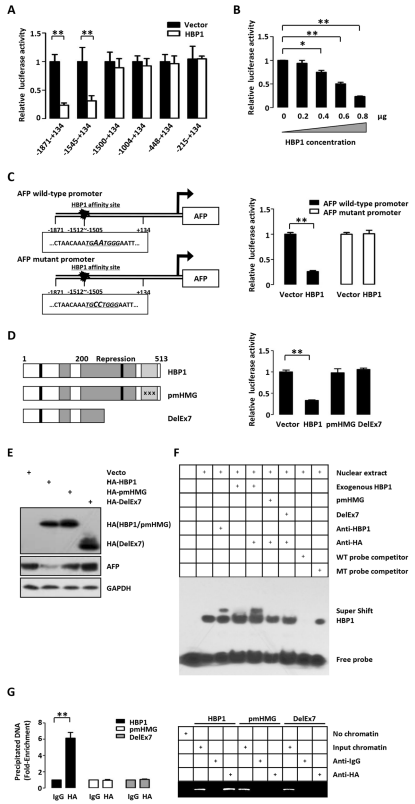
接下来,作者研究了HBP1是否以DNA结合依赖的方式调控AFP的启动子活性。作者发现,AFP启动子在距离转录起始位点-1512至-1505 bp的位置包含一个HBP1的亲和位点(TGAATGGG)。作者将表达HBP1和不同AFP启动子缺失突变体报告基因的质粒共转染入293T细胞。结果表明,HBP1抑制了包含HBP1亲和位点(-1871至+134、-1545至+134)的报告基因,而HBP1对缺失了HBP1亲和性位点 (-1500至+134、-1004至++134、 -448至+134、-215至+134)的报告基因没有影响。HBP1也以剂量依赖的方式抑制AFP启动子的活性。
为了进一步验证HBP1作用需要的DNA结合位点,作者构建了AFP启动子的突变报告基因,其结合位点在-1510发生突变(AA变为CC)。HBP1抑制了野生型AFP启动子的活性,但对突变体无影响。接下来检测HBP1是否依赖DNA结合而进行转录抑制,作者使用了两种HBP1的突变体: pmHMG(HMG域有三个氨基酸突变,缺乏DNA结合能力)和DelEx7(从乳腺癌组织中分离出来的,缺乏DNA结合域和部分抑制域)。结果表明,野生型HBP1降低了AFP启动子活性和蛋白表达水平,而pmHMG和DelEx7的过表达则无影响。由于HBP1抑制了AFP启动子的活性,作者测试了HBP1是否可以直接与AFP启动子结合。电泳迁移实验(EMSA)和染色质免疫沉淀实验(ChIP)结果表明,HBP1在体内外均可直接结合到AFP启动子的特异性亲和位点,而pmHMG和DelEx7则无法与AFP启动子结合。
3、HBP1在K419位点的乙酰化是其抑制AFP转录所必需的
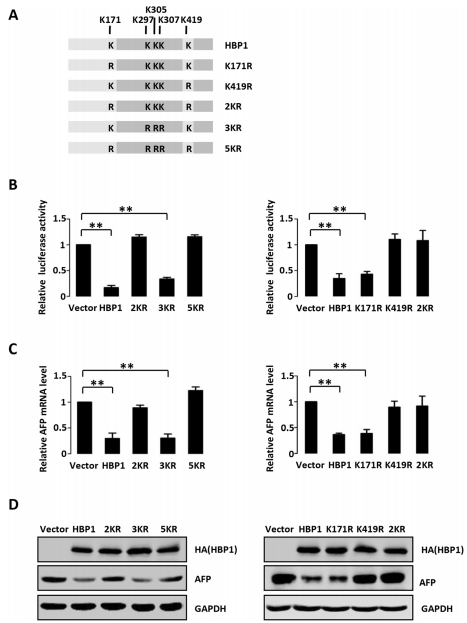
作者之前的研究表明,HBP1在5个赖氨酸位点(转录抑制域:K292、K305、K307,P域:K171和K419)被p300/CBP乙酰化。HBP1的乙酰化是其转录因子活性所必需的。为了研究HBP1的乙酰化是否影响其对AFP的转录抑制,作者使用了不同的HBP1突变体:K171R、K419R、2KR (K171/419R)、3KR (K297/305/307R)、5KR (K171/419/297/305/307R),将AFP荧光素酶报告基因与野生型HBP1或HBP1乙酰化突变体共转染入293T细胞。结果表明,野生型HBP1抑制了AFP的启动子活性。转录抑制域内的3KR乙酰化缺失突变体与野生型HBP1的结果相似,而突变体2KR和5KR对AFP启动子荧光素酶没有抑制作用。与这些结果一致的是,野生型HBP1和突变体3KR降低了AFP的mRNA和蛋白表达水平,而与对照载体相比,2KR或5KR突变体的过表达对AFP的表达没有影响。作者进一步研究发现,HBP1在K419位点的乙酰化是其抑制AFP的转录所必需的。同样,AFP的mRNA和蛋白表达水平的调节依赖于HBP1在K419位点的乙酰化。这些数据表明,HBP1在K419位点的乙酰化对其抑制AFP转录至关重要。
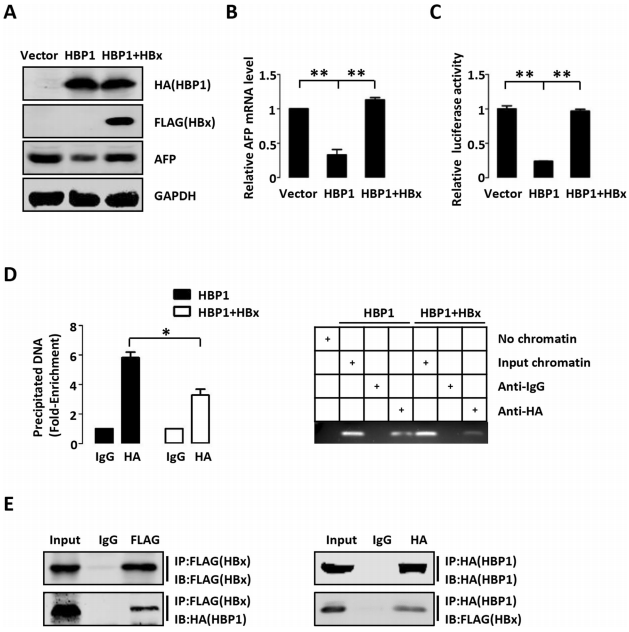
4、HBx通过阻止HBP1与AFP启动子的结合而减弱HBP1对AFP的抑制作用
肝癌的发生与乙型肝炎病毒(HBV)的感染密切相关。HBx是一种HBV调控蛋白,可上调AFP的表达,促进HBV相关肝癌的发展。作者在HepG2细胞中将HBP1和HBx过表达,或只过表达HBP1,以确定HBx是否通过抑制HBP1对AFP的下调来促进肝癌的发展。结果表明,HBx挽救了HBP1介导的AFP蛋白水平、mRNA水平和启动子活性的下降。作者接下来研究了HBx是否会影响HBP1与AFP启动子的结合。ChIP结果证实,HBx降低了HBP1与AFP启动子的结合。co-IP实验结果表明,外源性HBx可以与HBP1相互作用。因此,作者推测HBx可能通过与HBP1相互作用而抑制了HBP1与AFP启动子的结合。结合组织芯片分析结果,即 HBs Ag+肝癌患者的HBP1蛋白水平低于HBs Ag-肝癌患者,这表明在HBs Ag+肝癌患者中,HBP1对AFP的抑制可能是因为HBP1的低表达而降低,进而促进了肝癌的进展。
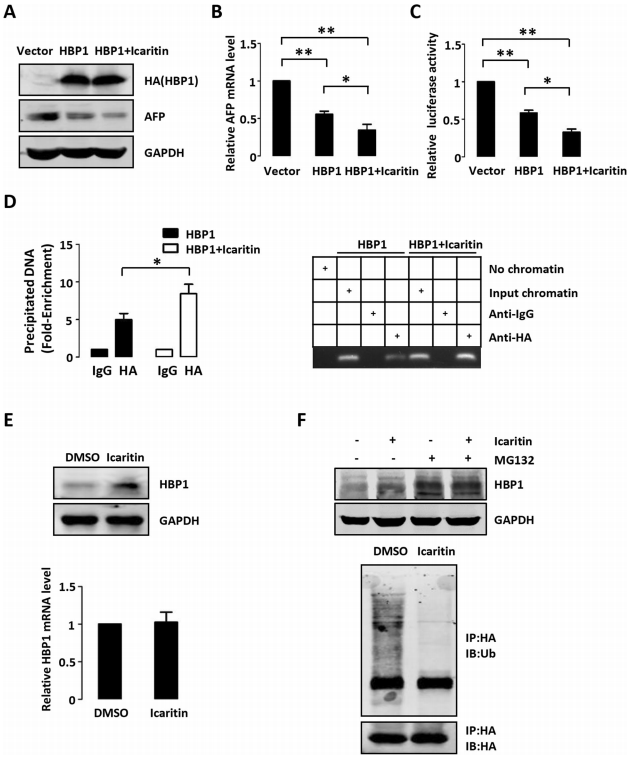
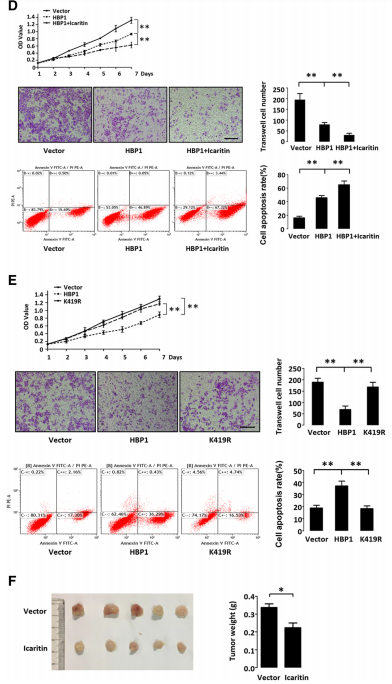
5、淫羊藿苷通过增强HBP1与AFP启动子的结合而促进HBP1对AFP的抑制作用
淫羊藿苷是中药淫羊藿的一种活性成分,已被证实具有广泛的生物和药理功能,如增强免疫力、抗氧化和抗癌等。已有研究报道,淫羊藿苷通过激活caspase通路和抑制IL-6/Jak2/Stat3信号通路,促进肝癌细胞凋亡,从而抑制肝癌细胞的生长。Zhang等证明了淫羊藿苷通过促进miRNA介导的AFP的mRNA降解而降低AFP的表达。因此,作者下一步研究了淫羊藿苷是否干扰了HBP1对AFP的抑制。在HepG2细胞中过表达HBP1,淫羊藿苷处理前后检测AFP的蛋白水平、mRNA水平和启动子活性。结果表明,与单独使用HBP1相比,添加淫羊藿苷后,HBP1对AFP的抑制作用更为显著。ChIP实验表明,淫羊藿苷能增强HBP1与AFP启动子的结合。为了进一步研究淫羊藿苷如何增强HBP1的转录抑制,作者检测了淫羊藿苷处理后HepG2细胞中HBP1的蛋白和mRNA水平。结果表明,淫羊藿苷增加了HBP1蛋白的表达,但对mRNA水平没有影响。此外,淫羊藿苷抑制了HBP1泛素化介导的蛋白酶体降解。因此,作者得出结论,淫羊藿苷通过抑制HBP1的泛素化从而提高HBP1的表达,进而增强HBP1与AFP启动子的结合。
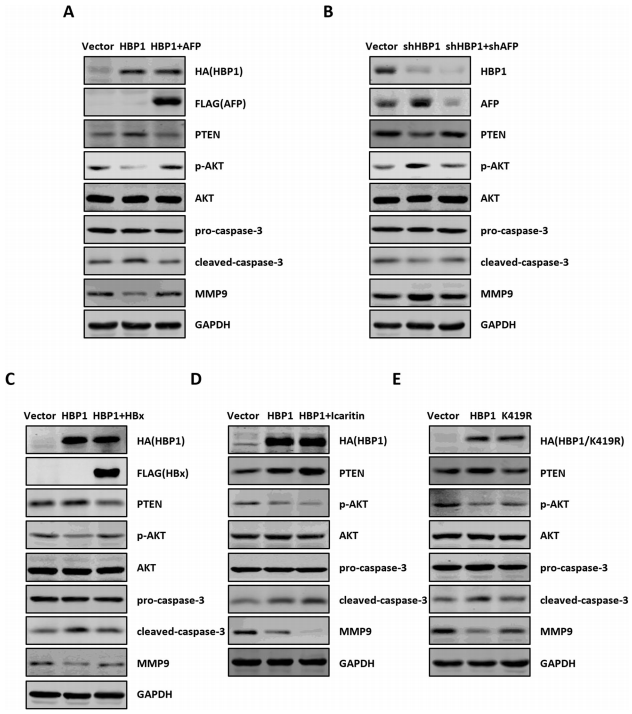
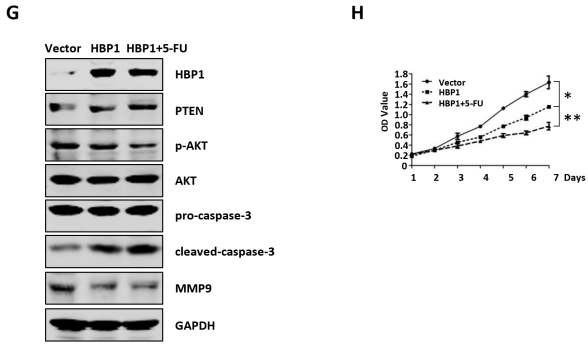
6、HBP1对AFP的抑制降低了AFP对肝癌细胞中PTEN、MMP9和caspase-3蛋白水平的影响
已有研究报道,AFP通过与PTEN、MMP9、caspase-3相互作用,阻断其对PI3K/AKT、肿瘤转移和caspase信号的作用,从而发挥肿瘤促进作用。作者测试了HBP1对AFP的抑制是否会减弱AFP对HepG2细胞中PTEN、MMP9和caspase-3的影响。结果表明,HBP1的过表达增加了PTEN蛋白的表达,降低了磷酸化的AKT水平。同时,HBP1增强了pro-caspase-3到cleaved-caspase-3进程,降低了MMP9的蛋白水平,而AFP的共表达则可以挽救HBP1介导的PTEN、caspase-3和MMP9蛋白的改变。此外,HBP1的敲除增加了AFP的表达,降低了PTEN和cleaved-caspase-3的表达水平,并增加了磷酸化AKT和MMP9的水平,但当AFP敲除时,则没有影响。作者也检查了K419R突变体,发现它对这些蛋白质的表达没有影响。这些结果表明,HBP1通过抑制AFP提高了PTEN和cleaved-caspase-3蛋白水平,降低了MMP9蛋白水平,HBP1是通过其在K419位点的乙酰化而发挥这些作用的。
作者还测试了HBx或淫羊藿苷在HBP1介导的这些蛋白表达中的调控作用。结果表明,HBx挽救了HBP1介导的这些蛋白的表达趋势,而淫羊藿素增强了HBP1介导的这些蛋白的表达趋势,提示HBx或淫羊藿素通过调节HBP1-AFP轴影响PTEN/AKT、caspase-3和MMP9信号。
7、HBP1在肝癌细胞中通过抑制AFP而抑制肿瘤恶性
由于HBP1通过抑制AFP而上调了AKT和caspase-3信号通路并降低了转移相关蛋白MMP9的表达,作者接下来研究了HBP1对AFP的抑制表达在HepG2细胞活性、迁移和凋亡中的作用。生长曲线和Transwell实验显示,HBP1降低了细胞活性和细胞迁移;流式细胞(FACS)实验显示,HBP1增加了H2O2诱导的细胞凋亡反应。AFP则挽救了HBP1诱导的细胞增殖和迁移的减少,也挽救了细胞凋亡的增加。HBP1敲除的细胞具有较高的生长速率和细胞迁移能力,H2O2诱导的凋亡率较低;而在HBP1基因下调的细胞中,通过shRNA下调AFP则可降低细胞增殖和迁移能力,以及减少细胞凋亡。
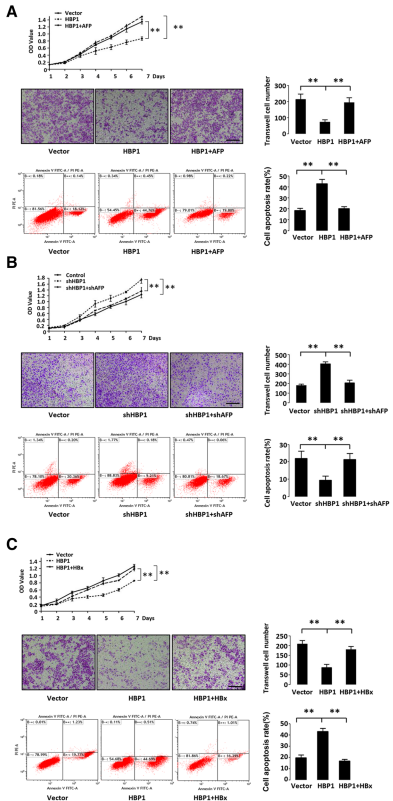
为了进一步确定HBx或淫羊藿苷的治疗是否会改变肝癌细胞的恶性程度,作者在HepG2细胞中稳定转染HBP1,同时转入(或不转入)慢病毒过表达的HBx或淫羊藿苷。实验结果表明,HBx挽救了HBP1介导的细胞增殖和迁移的减少,细胞凋亡的增加;而淫羊藿苷则增强了HBP1介导的细胞增殖和迁移的减少,细胞凋亡的增加。淫羊藿苷能抑制HepG2细胞在裸鼠的肿瘤发生。这些结果表明,HBP1通过抑制AFP的表达而抑制肝癌细胞的恶性程度,HBx或淫羊藿苷通过调节HBP1-AFP轴而影响肝癌细胞的恶性程度。作者还检测了K419R突变体,证实了HBP1对细胞增殖、迁移和凋亡的影响依赖于其K419位点的乙酰化。
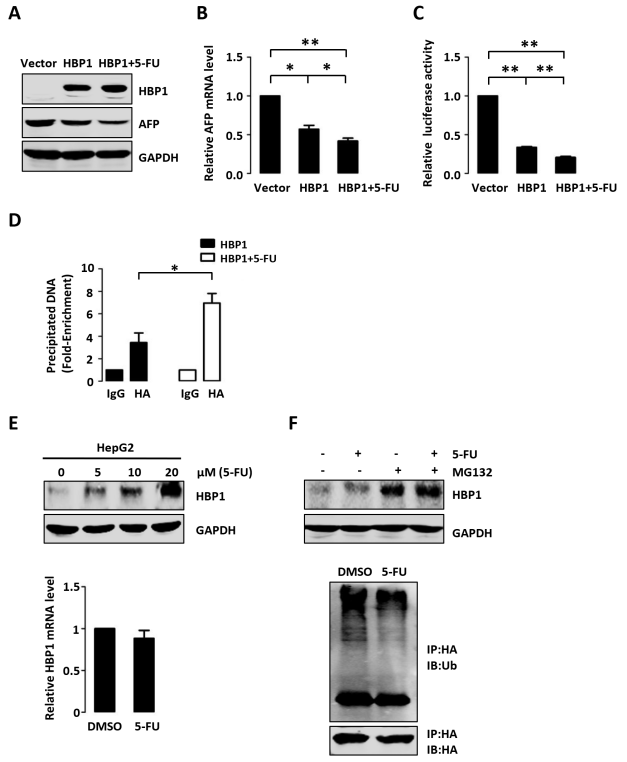
5-氟尿嘧啶(5-FU)是临床上广泛应用的抗肝癌药物。为了检测5-FU是否具有和淫羊藿苷对HBP1或AFP的类似作用,作者分别对过表达HBP1的HepG2细胞在经(或不经)5-FU处理,进行了Western blotting、real-time PCR、ChIP和MTT检测。结果表明,5-FU通过抑制HBP1泛素化介导的蛋白酶体降解而增加了HBP1蛋白的表达,进而增强了HBP1对AFP启动子的抑制。此外,5-FU增强了HBP1介导的PTEN/AKT、caspase-3和MMP9蛋白的表达趋势,并增强了HBP1介导的细胞增殖抑制。这些结果表明,5-FU对HBP1或AFP的作用与淫羊藿苷类似,能通过调节HBP1-AFP轴而抑制肝癌的进展。
8、HBP1的表达缺失可恶化DEN/CCl4诱导的肝癌
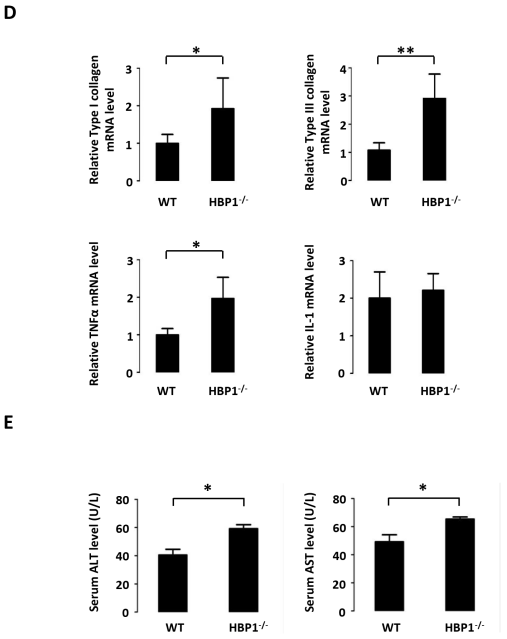
为了进一步研究HBP1在肝癌发生发展中的作用,作者使用CRISPR/Cas9系统构建了HBP1基因敲除小鼠。去除了HBP1基因第三外显子的194个碱基对,阻止了HBP1基因的转录,导致HBP1蛋白的表达缺失。在对新生小鼠进行遗传鉴定后,作者选择了野生型和HBP1缺陷型两种小鼠,并随机每组分配6只野生型和6只HBP1缺陷型小鼠。一组用DEN/CCl4处理以构建小鼠肝纤维化和肝癌模型,另一组用生理盐水/橄榄油处理作为阴性对照。约12周后,首先构建成功了小鼠肝纤维化模型。将小鼠处死并切除肝脏进行分析。结果表明,与HBP1野生型小鼠相比,DEN/CCl4处理HBP1缺陷型小鼠的肝脏中形成了更多的炎症细胞浸润和坏死灶。Masson染色和Sirius Red染色显示,肝纤维化仅发生在DEN/CCl4处理的小鼠组,而HBP1缺陷型小鼠的肝纤维化更严重。在阴性对照组中,野生型或HBP1缺陷型小鼠均没有肝损伤和纤维化。然后作者检测了小鼠肝脏中与肝纤维化相关的几种炎症因子的蛋白和mRNA表达水平。结果表明,与野生型HBP1小鼠相比,HBP1缺陷型小鼠肝脏中I型胶原、III型胶原和TNF-α的蛋白和mRNA表达水平升高,而IL-1β的表达水平不变。作者也测定了小鼠血清中ALT和AST水平。结果表明,DEN/CCl4处理后ALT和AST水平均升高,且HBP1缺陷型小鼠较野生型小鼠升高更明显,提示DEN/CCl4处理后HBP1缺陷型小鼠肝功能损伤更严重,而阴性对照组小鼠的ALT和AST水平均未升高。

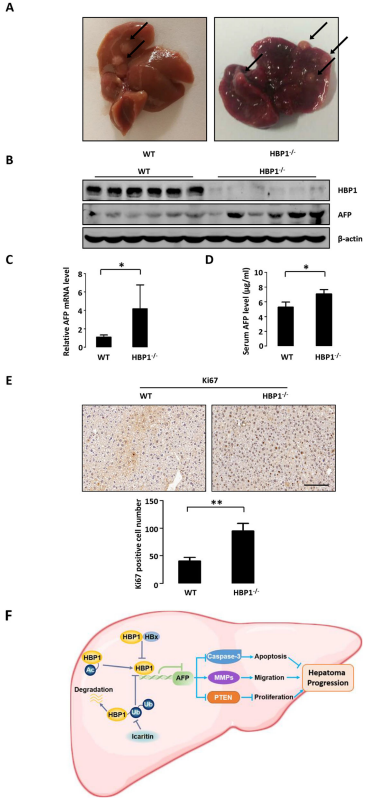
在另一个单独实验中,用DEN/CCl4或生理盐水/橄榄油(阴性对照)处理小鼠较长时间(约20周)诱导形成肝癌。与野生型小鼠相比,HBP1缺陷型小鼠的肝脏肿瘤组织块更多,肿瘤组织体积更大。此外,HBP1缺陷型小鼠的肝脏表面可见多发结节,而野生型小鼠肝脏相对光滑。在HBP1缺陷型小鼠的肝脏中,AFP蛋白水平和mRNA水平均升高。由于AFP是原发性肝癌的血清标志物,作者用ELISA法检测了小鼠血清中AFP的含量,发现HBP1缺陷型小鼠的血清中AFP的水平高于野生型小鼠。石蜡切片免疫组化染色结果显示,与野生型小鼠相比,HBP1缺陷型小鼠的Ki67表达更高,提示在DEN/CCl4诱导的肝癌模型中,HBP1缺陷型小鼠肝癌恶性程度更高。综上所述,这些数据表明,HBP1的表达缺失加重了DEN/CCl4诱导的小鼠肝损伤、肝纤维化和肝癌。
研究结论
HBP1对AFP的下调与肝癌细胞的转移和肝癌患者的预后差有关。在正常情况下,HBP1通过下调AFP的表达而抑制肿瘤的发生。在肝癌发展过程中,这一生物学过程可因HBP1异常低表达而逆转,促进了AFP对PTEN、MMP9和caspase-3的作用,从而诱导肝癌细胞的增殖和迁移,并抑制肝癌细胞的凋亡。作者确定了HBP1的高表达抑制肝癌进展的新机制,为肝癌治疗开辟了新的治疗途径。作者认为,HBP1的表达水平可以作为肝癌治疗和预后监测的有用指标,从而更好地改善肝癌患者的预后。
参考文献
Cao Z, Cheng Y, Wang J, et al. HBP1-mediated transcriptional repression of AFP inhibits hepatoma progression[J]. Journal of Experimental & Clinical Cancer Research, 2021, 40(1): 1-20.





