
研究路线

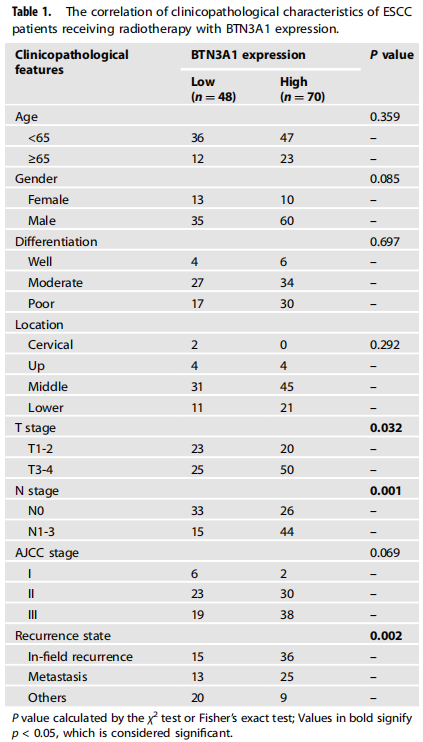
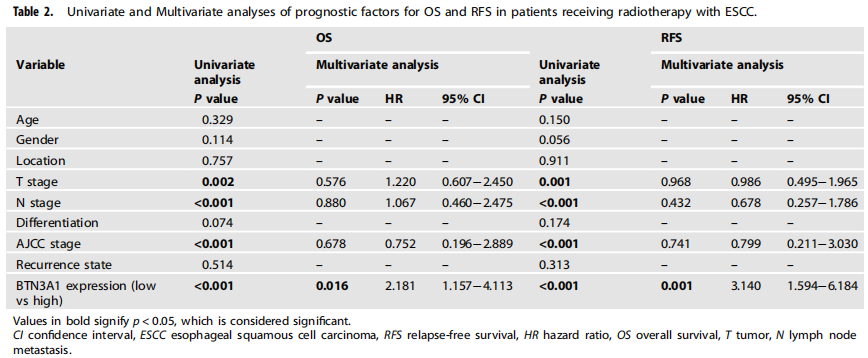
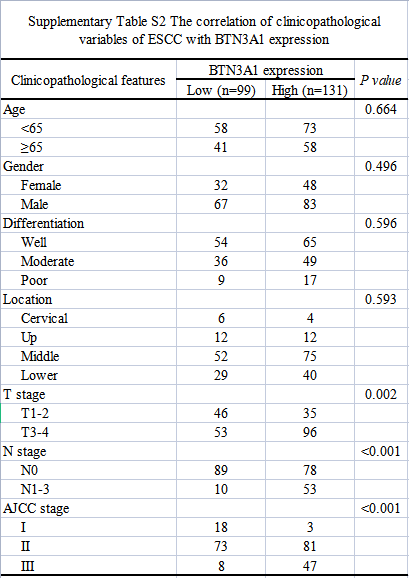
作者收集了118例患者样本,并通过免疫组化(IHC)染色检测了BTN3A1在肿瘤和邻近非肿瘤组织中的表达。结果表明,BTN3A1主要定位于细胞质,仅有少数分布于细胞表面,且在肿瘤组织中表达明显增加。基于BTN3A1的平均表达水平,将样本分为BTN3A1高表达组(n=70)和BTN3A1低表达组(n=48)。BTN3A1的表达与患者的临床病理特征的相关性分析表明,淋巴结转移(N分期)(p=0.001)和肿瘤浸润(T分期)(p=0.032)与BTN3A1的高表达显著相关。此外,在118例患者中,51例在PORT术后发生了野内复发(43.2%)。BTN3A1的高表达与野内复发率和远端转移率呈正相关(p<0.001)。Kaplan-Meier生存分析显示,BTN3A1的低表达与较长的总生存期和无复发生存期相关。单因素和多因素分析也表明,BTN3A1是无复发生存期 (p<0.05)和总生存期 (p<0.05)的独立预后指标。ROC曲线分析表明,针对总生存期,BTN3A1的AUC值为:0.610 (p=0.04);针对无复发生存期,AUC值为:0.719 (p<0.001)。此外,作者利用组织芯片,检测了未接受放疗的ESCC患者的肿瘤和非肿瘤组织中BTN3A1的蛋白水平,并研究了BTN3A1的表达与临床病理特征之间的相关性。结果表明,BTN3A1表达上调与T分期(p=0.002)、N分期(p<0.001)和TNM分期(p<0.001)显著相关。Kaplan-Meier生存分析显示,BTN3A1的表达上调预示预后不良。



2、BTN3A1作为原癌基因在体内外促进ESCC的生存
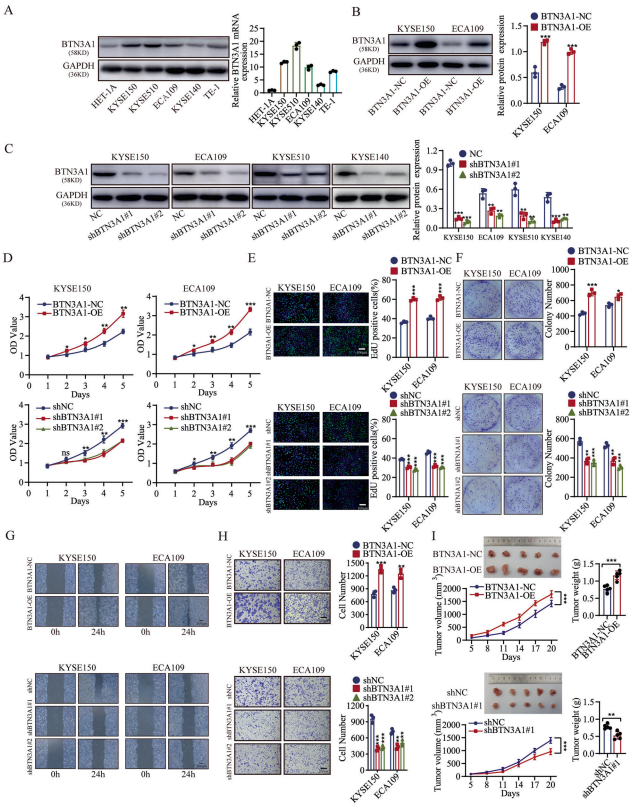
BTN3A1的研究主要集中在其与pAgs的结合和向Vγ9Vδ2 T细胞呈递,但尚未有关于其在ESCC中相关作用的报道。作者采用WB和RT-PCR方法,在ESCC细胞系:KYSE150、KYSE510、ECA109、KYSE140和TE-1,以及正常食管鳞状细胞系:HET-1A中检测了BTN3A1表达。结果表明,BTN3A1在ESCC细胞系中的表达高于正常细胞系。此外,作者还检测了BTN3A1在细胞中的定位。免疫荧光(IF)染色显示,BTN3A1主要定位于ESCC细胞的细胞质中,只有少数分布在细胞表面。作者构建了BTN3A1表达上调或下调的KYSE150和ECA109细胞系。CCK-8检测显示,BTN3A1的过表达促进细胞增殖,而BTN3A1的表达下调则阻碍细胞增殖。EdU染色显示,BTN3A1过表达细胞的DNA复制率较高。接下来,集落形成实验结果显示,BTN3A1的过表达加速了细胞集落形成。作者还进行了伤口愈合试验和transwell迁移试验,用以评估细胞的活力。结果显示,BTN3A1的过表达增强了肿瘤细胞的恶性程度。动物模型的结果表明,BTN3A1促进异种移植瘤生长,表现为肿瘤体积增大和肿瘤重量增加。这与细胞系的结果一致。

3、BTN3A1的表达敲除可使体内外的ESCC细胞对放疗敏感
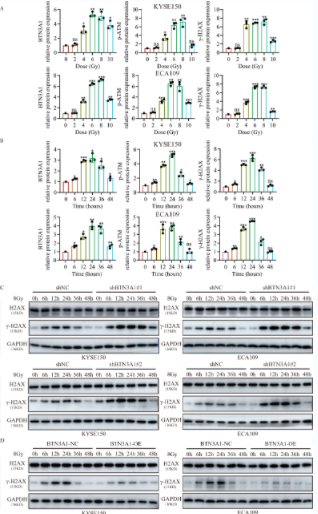
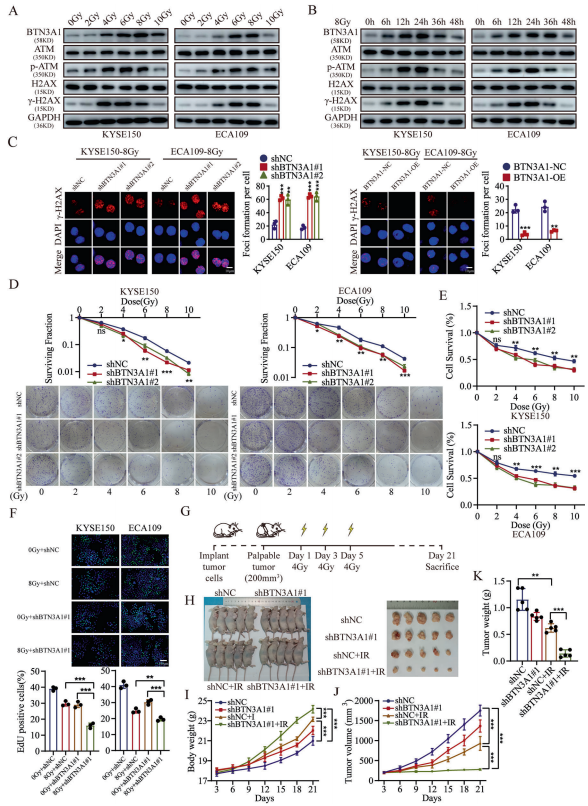
作者接下来研究了BTN3A1的表达与放疗之间的关系。研究表明,放疗对BTN3A1的蛋白表达水平有正向影响,并增加了p-ATM和γ-H2AX的表达。此外,作者检测了BTN3A1表达的时间依赖性效应,发现BTN3A1的表达增加呈放疗时间依赖性。BTN3A1的表达在放疗6小时后开始增加。BTN3A1、p-ATM和γ-H2AX蛋白表达的统计分析如下图所示。作者进一步检测了γ-H2AX在放疗后的BTN3A1-KD和BTN3A1-OE细胞中的水平。WB分析表明,BTN3A1的表达敲除使ESCC细胞对放疗诱导的DNA损伤呈时间依赖性,而BTN3A1过表达使ESCC细胞对放疗诱导的DNA损伤不敏感。同时,IF染色显示,γ-H2AX灶在BTN3A1-KD细胞中数量明显增加。集落形成实验表明,BTN3A1的表达敲除的KYSE150和ECA109细胞的克隆潜能在放疗后显著降低。与上述结果一致,CCK-8试验显示,BTN3A1表达敲除的细胞的存活率低于对照细胞。EdU染色显示,BTN3A1的表达敲除可导致ESCC细胞对放疗敏感。接下来,作者构建了BTN3A1质粒(shMT,同义突变)并转染入KYSE150细胞,以恢复BTN3A1在表达敲除后的表达。结果表明,BTN3A1在敲除细胞中的表达恢复,同时,放疗耐受也得以恢复。
作者使用BTN3A1稳定敲除的KYSE150细胞系构建了小鼠异种移植瘤模型,并对特定的肿瘤区域放疗,以验证BTN3A1的表达敲除是否使ESCC细胞在体内对放疗敏感。与非放疗组相比,放疗中度抑制了对照组的肿瘤生长(p<0.01),显著抑制了BTN3A1表达敲除组的肿瘤生长(p<0.001)。接受放疗和BTN3A1敲除两种处理的小鼠体重增加,肿瘤生长较慢(p<0.001)。基于以上结果,作者认为,BTN3A1的表达敲除可使ESCC细胞对放疗敏感,BTN3A1抑制剂可作为提高ESCC患者放疗疗效的药物而被开发。
4、BTN3A1的表达敲除降低了ESCC细胞的自噬水平
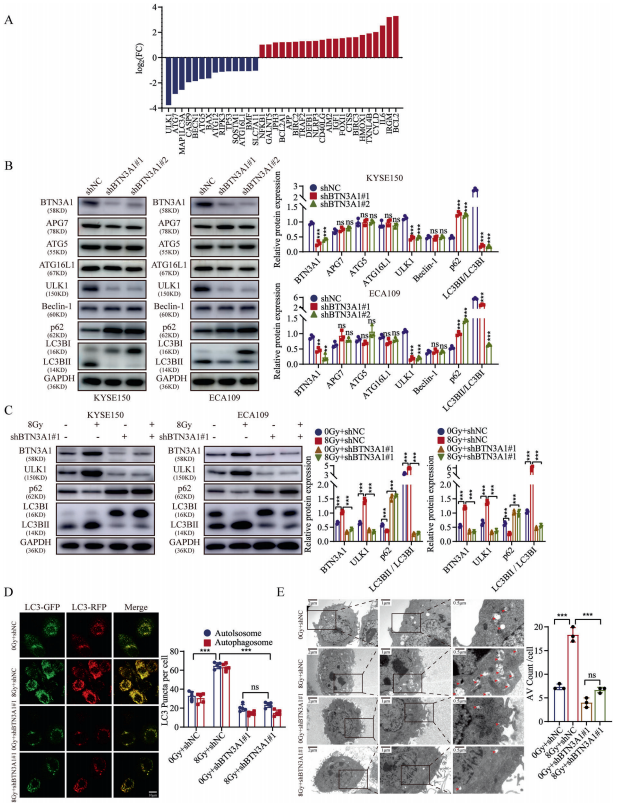
作者使用PCR芯片研究了与BTN3A1作用相关的死亡模式。shBTN3A1组与对照组相比较,共鉴定出35个显著差异表达的基因。在所有与特定细胞死亡模式相关的基因中,ULK1的相关性最高。此外,作者还用WB检测了与自噬、凋亡和焦亡相关的蛋白的表达。结果表明,与对照细胞相比,ULK1和MAP1LC3B/LC3B在BTN3A1表达敲除的细胞中的表达降低。接下来,作者研究了BTN3A1在放疗介导的自噬中的潜在作用。放疗(8Gy)后,与对照细胞相比,ULK1和LC3BII/LC3BI在BTN3A1表达敲除的细胞中的表达降低,p62/SQSTM1的表达增加。通过将mRFP-GFP-LC3慢病毒载体转染入KYSE150细胞,作者研究了BTN3A1对自噬体(黄色斑点)和自溶酶体(红色斑点)形成的影响。数据显示,BTN3A1的表达降低逆转了ESCC细胞中放疗所激活的自噬通量。作者通过透射电镜观察了KYSE150细胞的超微结构,每个切片随机选取12个细胞并对自噬液泡(AVs)进行计数。与对照细胞相比,BTN3A1的表达缺失显著减少了放疗细胞中的AVs数量(p<0.001)。BafA1是一种已知的自噬后期的抑制剂,可阻止p62的降解,作者用其来确定BTN3A1是否调控自噬体的形成或自噬通量。结果表明,BTN3A1增加了KYSE150细胞中LC3B-I向LC3B-II的转化和mRFP-GFP-LC3 puncta的积累;而BafA1通过阻断LC3BII的降解和自噬通量而抑制BTN3A1的功能。综上所述,这些结果表明,BTN3A1参与了自噬过程,其在ESCC细胞中的表达敲除降低了放疗诱导的自噬水平。
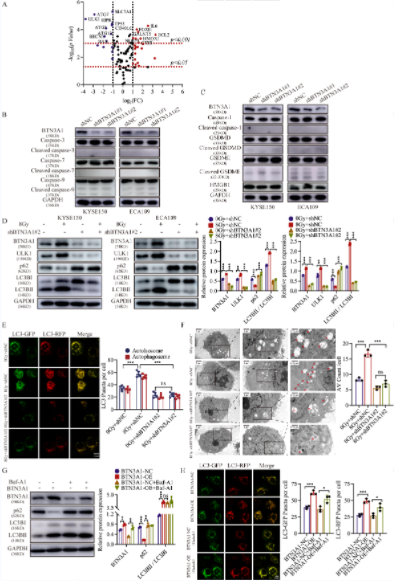
5、BTN3A1通过激活自噬而促进细胞的放疗耐受
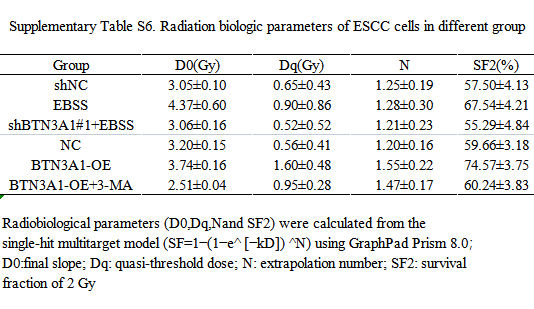
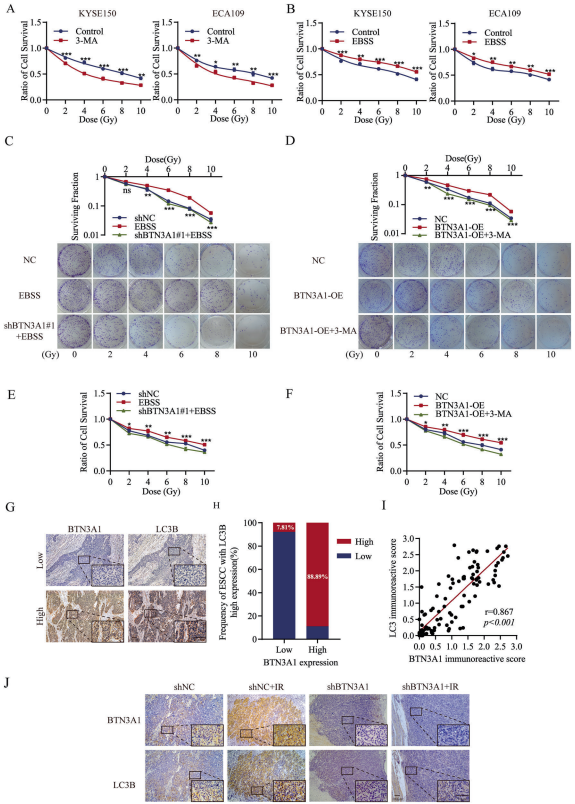
越来越多的证据表明,自噬有助于癌细胞的放疗耐受。本研究中,作者发现3-MA(一种自噬抑制剂)的处理增强了ESCC细胞对放疗的敏感性;而通过诱导饥饿(使用EBSS)则增加了自噬水平,ESCC细胞的放疗耐受能力也明显增强。作者通过集落形成来确定BTN3A1是否通过自噬途径调节ESCC中的放疗耐受。结果表明,经EBSS处理的KYSE150细胞对放疗的敏感性低于对照组细胞;而将BTN3A1特异性shRNA的慢病毒转染入EBSS处理的细胞后,放疗敏感性有一定程度的提高,而对照组则无差异。转染BTN3A1质粒的KYSE150细胞比对照细胞对放疗更加耐受, 而3-MA的处理可以使细胞对放疗再次敏感。CCK-8测定也获得了一致的结果。作者的结果表明,BTN3A1的表达敲除所诱导的放疗致敏至少部分是由于自噬水平的降低而造成的。
随后,作者研究了ESCC样本中BTN3A1表达与自噬之间的关系。免疫组化染色显示,LC3B在肿瘤组织中的蛋白表达与BTN3A1的表达呈正相关(r=0.867, p<0.001)。此外,放疗增加了LC3B的表达,但这种改变随着移植瘤中BTN3A1的下调而减弱。
6、BTN3A1激发了ULK1介导的自噬
为了研究BTN3A1参与自噬的机制,作者分析了TCGA数据库中的基因表达谱数据。分析表明,BTN3A1与自噬相关基因:ULK1、CASP8、CFLAR、TNFSF10和ATG4C的表达显著相关(p<0.001)。同时,作者也从GEO数据库中选择了独立的ESCC病例队列(50例,GSE161533、GSE20347和GSE17351)进行分析。结合TCGA数据库和GEO数据库的分析结果,作者推测BTN3A1的表达与ULK1的表达相关。IF染色显示,BTN3A1和ULK1在ESCC细胞中共定位。随后,作者在KYSE150细胞中进行免疫共沉淀(Co-IP)实验,并通过质谱分析特异性抗体所下拉的蛋白。结果表明,只有BTN3A1组可以检测到ULK1。在KYSE150细胞和ECA109细胞中,Co-IP也证实了BTN3A1与ULK1相互作用。BTN3A1介导的自噬可能与ULK1基因有关。研究表明,ULK1被多个上游激酶,如:mTOR和AMPK在不同的位点磷酸化,并影响其激酶活性。在本研究中,BTN3A1的过表达调节ULK1的表达,促进其Ser555位点的磷酸化。此外,BTN3A1的表达敲除抑制了KYSE150和ECA109细胞中ULK1 Ser555位点的磷酸化。作者通过WB研究了BTN3A1对ULK1通路的影响。1 μM MRT68921的处理抑制了ULK1活性,减少了BTN3A1的过表达所引起的自噬。这些结果表明,BTN3A1通过提高ULK1活性而诱导自噬;此外,ULK1激动剂(LYN-1604)可恢复BTN3A1的表达下调对自噬的抑制作用。

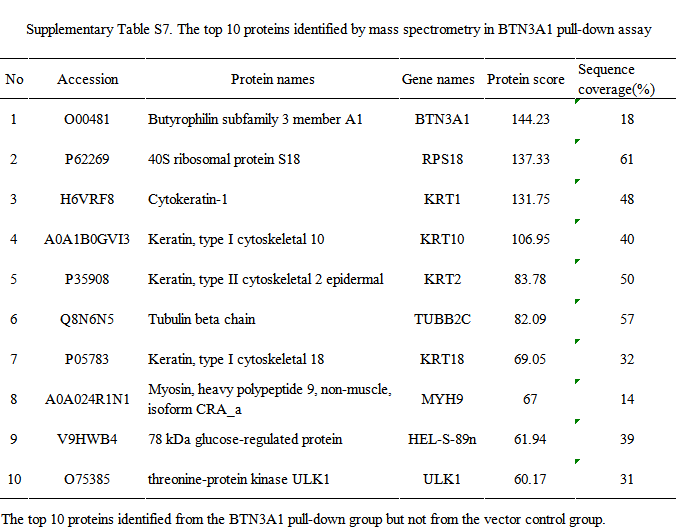
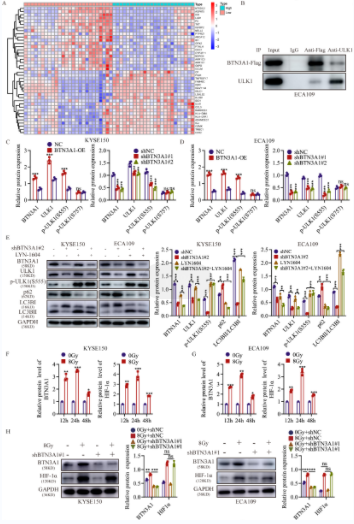
7、放疗通过HIF-1α介导的过程而增加BTN3A1的表达
放疗后,肿瘤的氧合趋于增加。文献表明,HIF-1α是信号转导的来源和肿瘤放疗敏感性的一个主要决定因素;辐射暴露可以诱导胰腺癌和肺癌中HIF-1α蛋白的表达。在本研究中,初步结果表明,放疗增加了BTN3A1和HIF-1α的表达;在细胞中加入2.5 μM 2-ME(HIF-1α抑制剂),放疗诱导的BTN3A1过表达被抑制。将HIF-1α shRNA转染入KYSE150和ECA109细胞,进一步证实了HIF-1α参与了放疗介导的BTN3A1表达。这些结果表明,放疗可能通过HIF-1α依赖的方式激活BTN3A1。IF染色显示,2-ME的处理导致BTN3A1和HIF-1α的表达水平明显低于对照组。作者也检测了BTN3A1敲低细胞中的HIF-1α表达。结果表明,BTN3A1的表达不影响HIF-1α的表达;BTN3A1可能是HIF-1α的下游基因。
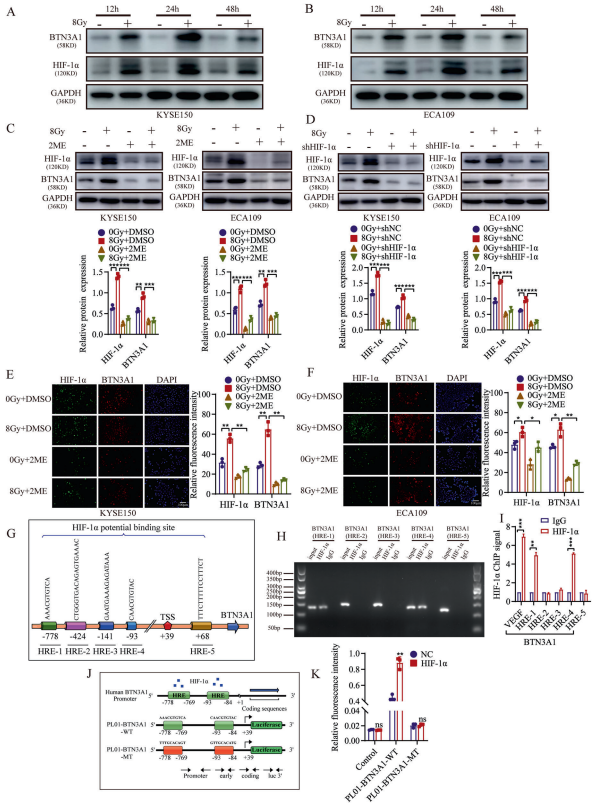
为了研究BTN3A1是否是HIF-1α的直接靶基因,作者首先通过ChIP-qPCR方法验证了Jaspar和hTF target预测的HIF-1α在BTN3A1启动子中的五个潜在结合位点。ChIP分析显示,BTN3A1(HRE-1)和BTN3A1(HRE-4)启动子区结合的HIF-1α显著增加。为了进一步确定HIF-1α是否与BTN3A1基因组序列相互作用,作者将pM14空载体和pM14 HIF-1α载体、pL01 BTN3A1-hRluc/SV40, 或pL01 BTN3A1-hRluc/SV40 MUT载体共转染入KYSE150细胞。结果表明,BTN3A1报告基因荧光素酶活性在转染入HIF-1α载体的细胞中比未转染HIF-1α载体的细胞高两倍多。基于这些结果,作者认为BTN3A1是HIF-1α的直接靶基因,放疗可能通过增加HIF-1α表达水平而上调BTN3A1的表达。
研究结论
本研究,作者首次发现BTN3A1在ESCC组织中高表达;BTN3A1的高表达与淋巴结转移和肿瘤浸润正相关,BTN3A1表达上调是预测ESCC患者预后不良的独立因素。此外,作者首次报道了BTN3A1的表达与放疗耐受相关。机制上,放疗通过增加HIF-1α表达水平而上调BTN3A1的表达;BTN3A1进而调控ULK1的表达并促进其Ser555位点的磷酸化从而诱导自噬。
本研究指出,靶向BTN3A1可能是提高ESCC患者放疗疗效的一种有前途的策略。





