卵巢癌(OC)是一种侵袭性妇科肿瘤,预后较差,5年总生存率低于50%。与大多数肿瘤一样,卵巢癌患者仅在早期可获得良好的治疗和预后结果。然而,卵巢癌患者早期确诊率仅为20%,大多卵巢癌患者确诊时已经为晚期,这在很大程度上是卵巢癌患者预后不理想的原因。由此可见,目前卵巢癌的生物标志物和治疗方法仍有缺陷,探索新的诊断和预后的生物标志物和治疗靶点对提高卵巢癌的诊治效率至关重要。
在肿瘤发生过程中,泛素结合酶被认为是一个组成酶家族,其表达异常和关键功能已被广泛研究。例如,UBE2T首先在范可尼贫血综合征(FA)被鉴定,通过催化FANCD2和FANCI的单泛素化,在范可尼贫血综合征的形成中发挥重要作用。UBE2T在实体瘤,如:胃癌、肝细胞癌、乳腺癌、肺癌、鼻咽癌、骨肉瘤、前列腺癌和肾细胞癌以及非实体瘤样多发性骨髓瘤(MM)中均上调,发挥致癌作用,并作为不良预后指标。一般来说,UBE2T的表达缺失通过调节致癌信号调节因子(如:PI3K/AKT、GSK3β/Wnt/β-catenin)的活性或调节抑癌因子(如:p53、FOXO1、GRP78和BRCA1)的稳定性而调控细胞周期、上皮间质转化(EMT)和凋亡,进而显著抑制肿瘤细胞的增殖、迁移、侵袭、干性和治疗耐受。虽然最近的生物信息学研究报道了UBE2T在卵巢癌中上调,但UBE2T在卵巢癌中的作用和潜在机制仍有待确认。
自噬作为维持细胞稳态的重要手段,在肿瘤发生过程中发挥着重要作用。自噬在癌变过程中的促肿瘤或抗肿瘤作用主要由自噬流的大小和降解底物决定,而自噬流和降解底物受到上游信号调节因子:AKT/mTOR、AMPK和MAPK通路的严格调控。理论上,UBE2T作为AKT的激活因子,可以调节自噬,这可能与UBE2T在癌症中的致癌作用有关。因此,作者研究了UBE2T在卵巢癌中的主要功能。
研究路线

研究内容
1、UBE2T在卵巢癌中表达上调
首先,作者通过几个专业网站分析了UBE2T的表达。分析表明,在Oncomine的两组数据中,与正常对照组相比,卵巢癌组织中UBE2T的mRNA表达显著上调。通过分析GEPIA(整合了TCGA和GTEx数据库)中的数据,进一步证实了卵巢癌中UBE2T的mRNA表达上调。此外,基于UALCAN的质谱蛋白质组学数据显示,UBE2T在卵巢癌中蛋白表达上调。最后,作者通过免疫组化染色分析了一个卵巢癌队列中UBE2T的蛋白水平。结果显示,UBE2T在卵巢癌组织中的染色强度明显强于正常标本。这些结果表明,UBE2T在卵巢癌中的mRNA和蛋白表达水平均有上调。

2、UBE2T的表达与卵巢癌患者的临床特征相关
随后,作者探讨了UBE2T的表达与卵巢癌患者的临床病理特征的相关性。Oncomine数据显示,不同组织学类型的卵巢癌(黏液型、浆液型、子宫内膜样型)UBE2T mRNA水平表达没有差异,免疫组化结果也证实了这一点。GEPIA的数据分析表明,UBE2T的mRNA表达水平与卵巢癌患者的分期呈负相关。然而,IHC数据显示,尽管UBE2T的蛋白表达在FIGO I期、II期、III期和IV期之间没有显著差异,但与早期(I+ II)卵巢癌相比,晚期(III+IV) 卵巢癌组织中UBE2T的表达显著上调,且UBE2T的表达水平与T分期呈正相关。但可能由于样本量有限,UBE2T的表达与远处转移、淋巴结转移相关性不明显。这些结果表明,UBE2T与卵巢癌患者的分期有关,提示UBE2T可能参与了卵巢癌的进展。

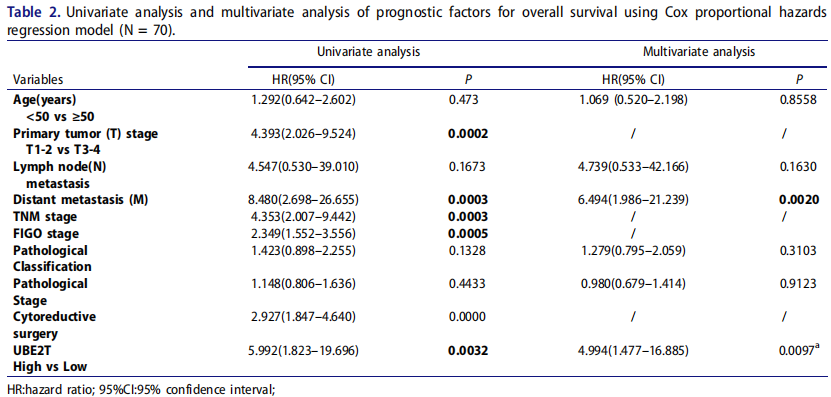
接下来,作者通过在线分析和实验检测,分析了UBE2T的表达与卵巢癌患者预后的关系。Kaplan-Meier Plotter数据分析显示,UBE2T的表达上调与卵巢癌患者的总生存期(OS)、无进展生存期(PFS)和进展后生存期(PPS)呈负相关。此外,GEPIA数据分析证实,UBE2T mRNA的表达升高与卵巢癌患者的总生存期差显著相关。与此一致,UBE2T蛋白的表达上调也是卵巢癌患者的不良预后指标。单因素Cox比例风险回归分析显示,T分期、FIGO分期、远处转移、UBE2T表达水平与卵巢癌患者的总生存期显著相关。多因素Cox比例风险回归分析显示,UBE2T的表达上调可作为卵巢癌患者总生存期差的独立预后因素。因此,这些结果证实了UBE2T与预后呈负相关,可作为卵巢癌患者预后不良的独立指标。

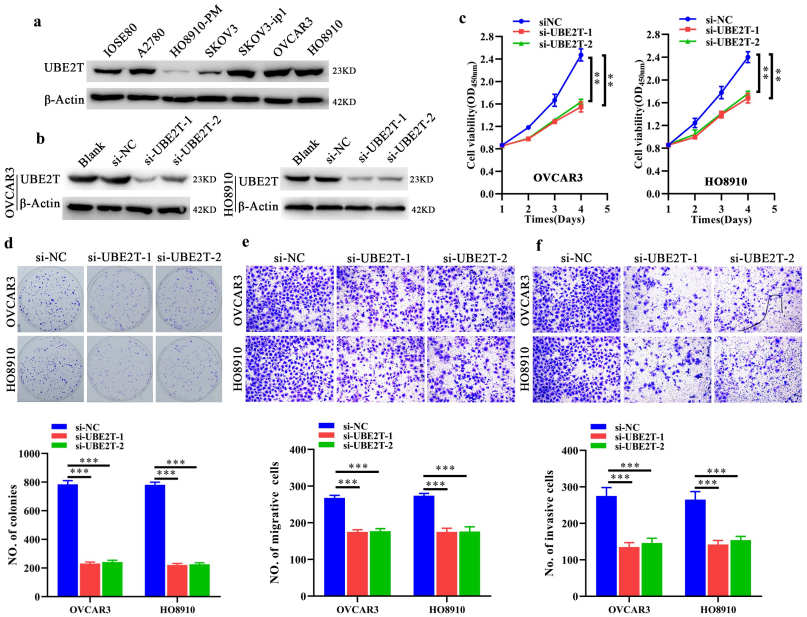
4、UBE2T的表达缺失抑制了卵巢癌细胞的生长、增殖和侵袭
接下来,作者进一步探讨了UBE2T在卵巢癌中的功能。作者检测了UBE2T在不同细胞系中的表达,并用si-UBE2Ts转染细胞,检测了UBE2T的表达缺失对卵巢癌细胞的影响。Western blot结果显示,与IOSE80细胞(正常卵巢上皮细胞)相比,卵巢癌细胞中UBE2T的表达显著升高,尤其是OVCAR3和HO8910细胞。转染siUBE2Ts后,UBE2T的表达被抑制,si-UBE2T-1和si-UBE2T-2分别在OVCAR3和SKOV3细胞中成功地抑制了UBE2T的表达。CCK-8、平板克隆形成和Transwell的迁移和侵袭实验表明,UBE2T的表达缺失显著抑制了卵巢癌细胞的生长、增殖和侵袭,表现为细胞活力受损、细胞克隆减少、迁移和侵袭细胞减少。本研究结果揭示,UBE2T的表达缺失可以抑制卵巢癌细胞的生长、增殖和侵袭。
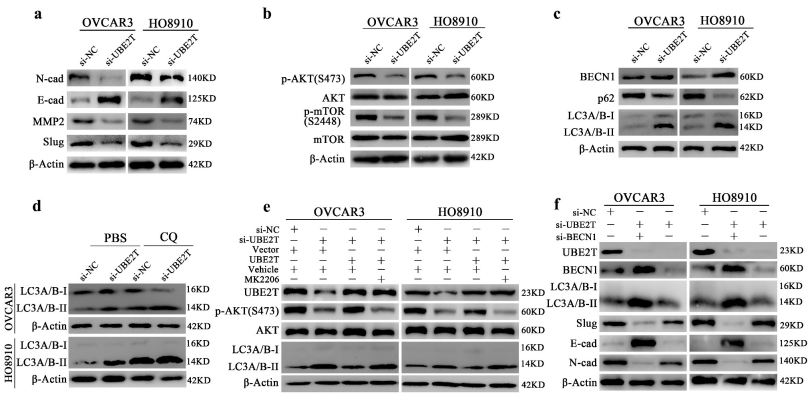
5、UBE2T的表达下调通过抑制AKT/mTOR而激活自噬进而抑制卵巢癌细胞的EMT和恶性进展
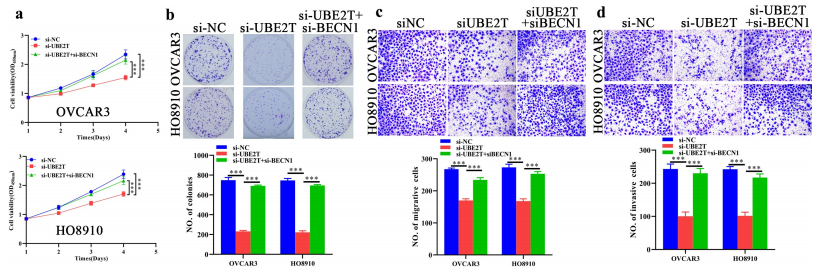
UBE2T在激活EMT和AKT中的作用已在多项研究中被揭示。作者接下来检测了UBE2T表达缺失的卵巢癌细胞的EMT和AKT活性。UBE2T的表达沉默抑制了EMT和AKT/mTOR的活性,表现为Slug表达减少,N-cadherin表达减少,E-cadherin表达增加,p-AKT (S473)和p-mTOR (S2448)表达减少。考虑到AKT/mTOR对自噬的调控作用,作者进一步分析了UBE2T表达改变对自噬的影响。结果表明,UBE2T的表达敲除激活卵巢癌细胞的自噬,表现为BECN1表达上调,LC3A/B-II积累,p62表达降低。此外,CQ (50 μM)处理后,LC3A/B-II的累积效应增强,进一步证实了UBE2T的损耗对卵巢癌细胞自噬流的增强作用。为了探究AKT/mTOR在UBE2T相关自噬中的作用,作者在内源性UBE2T表达缺失的卵巢癌细胞中挽回了UBE2T的表达。UBE2T的表达恢复挽回了其对自噬的抑制作用,而这种抑制作用可以被MK2206 (AKT抑制剂,2.5 μM)取消,通过LC3A/B-II积累水平证明了UBE2T可以通过维持AKT/mTOR活性而抑制自噬。此外,作者还探讨了UBE2T调控的自噬在EMT中的作用。结果表明,自噬通过BECN1的损耗而被外源性抑制后,通过Slug、N-cad和E-cad的表达水平可以看出,UBE2T表达敲除的卵巢癌细胞中,EMT被重新激活。同时,作者在CCK-8、平板克隆形成、Transwell迁移和Transwell侵袭实验中观察到了一致的表型。这些结果表明,UBE2T的下调通过抑制AKT/mTOR并激活自噬而抑制卵巢癌细胞的EMT和恶性进展。
研究结论
本文,作者证明了UBE2T的mRNA和蛋白水平在卵巢癌组织和细胞中显著上调,UBE2T的表达上调与卵巢癌患者的分期和预后呈负相关。机制上,UBE2T的下调抑制AKT/mTOR的活性,进而激活自噬,从而抑制EMT,最终抑制卵巢癌细胞的生长、增殖和侵袭。 作者的研究结果表明,UBE2T作为卵巢癌的预后生物标志物和治疗靶点,对于卵巢癌的诊断和治疗具有广阔的应用前景。
参考文献
Huang W, Huang H, Xiao Y, et al. UBE2T is upregulated, predicts poor prognosis, and promotes cell proliferation and invasion by promoting epithelial-mesenchymal transition via inhibiting autophagy in an AKT/mTOR dependent manner in ovarian cancer[J]. Cell Cycle, 2022: 1-12.





