三阴性乳腺癌(TNBC)的复发和死亡风险高于其他乳腺癌亚型,占乳腺癌病例的10-30%。由于缺乏雌激素受体、人表皮生长因子受体2和孕激素受体,无法从传统的乳腺癌靶向治疗中获益,因此寻找三阴性乳腺癌治疗的替代靶点一直是乳腺癌研究的热点。
放疗作为肿瘤局部治疗的一种选择,越来越多地应用于三阴性乳腺癌的术后管理,特别是在三阴性乳腺癌保乳治疗的有效性得到认可以后。术后放疗可使三阴性乳腺癌的10年复发率由35.0%降低至19.3%,且使15年生存率显著提高。然而,与其他乳腺癌亚型相比,三阴性乳腺癌对电离辐射(IR)的耐受性更强,这往往导致放疗后不可检测的转移性扩散和复发。复发或晚期三阴性乳腺癌对后续治疗反应较差,这些患者的中位生存时间约为18个月。因此,阐明三阴性乳腺癌的放疗耐受机制进而靶向治疗,对三阴性乳腺癌的治疗具有重要意义。
肿瘤干细胞(CSCs)在功能上被定义为具有自我更新和再现肿瘤异质性能力的肿瘤细胞。越来越多的证据表明,传统的乳腺癌治疗方法,包括化疗、放疗和激素治疗,通常会增加肿瘤中肿瘤干细胞的比例。在许多情况下,这些自我更新的肿瘤干细胞被认为通过增强DNA修复和上皮-间充质转化(EMT)而介导治疗耐受和转移扩散,导致治疗失败和疾病复发。与其他乳腺癌亚型相比,CD44+CD24−/低表达信号和/或高活性乙醛脱氢酶(ALDH)的肿瘤干细胞在三阴性乳腺癌组织和细胞系中更加富集;同时,与干性相关的通路,如JAK2/STAT3信号、酪氨酸蛋白激酶Src信号、Hedgehog信号和Wnt/β-catenin信号在三阴性乳腺癌中常被激活。因为三阴性乳腺癌的治疗仍依赖于传统的方法,所以靶向干性和根除瘤内肿瘤干细胞可能有助于提高三阴性乳腺癌的治疗效果。
THO复合物(THOC)是转录出核复合物TREX的一个亚基,在转录延伸、核RNA输出和基因组稳定中起着重要的调控作用。在哺乳动物中,THOC复合物由THOC1、2、3、5、6、7组成。其中,THOC2作为THO支架,THOC5作为剪接mRNA从细胞核释放的配体。这两种蛋白调控大量基因的表达和胚胎发育,特别是增殖和分化阶段。Wang等人发现,THOC2和THOC5可以通过调控一些多能性蛋白的表达,如:ESRRβ、KLF4、SOX2和NANOG,而调节小鼠胚胎干细胞的自我更新能力。此外,Yuan等发现,THOC2和THOC5通过改变血管平滑肌细胞(VSMC)标志物的表达而决定人血管平滑肌细胞的分化表型。然而,THOC2和THOC5在调控肿瘤干性中的作用尚未见报道,其机制尚不清楚。

研究路线

研究内容
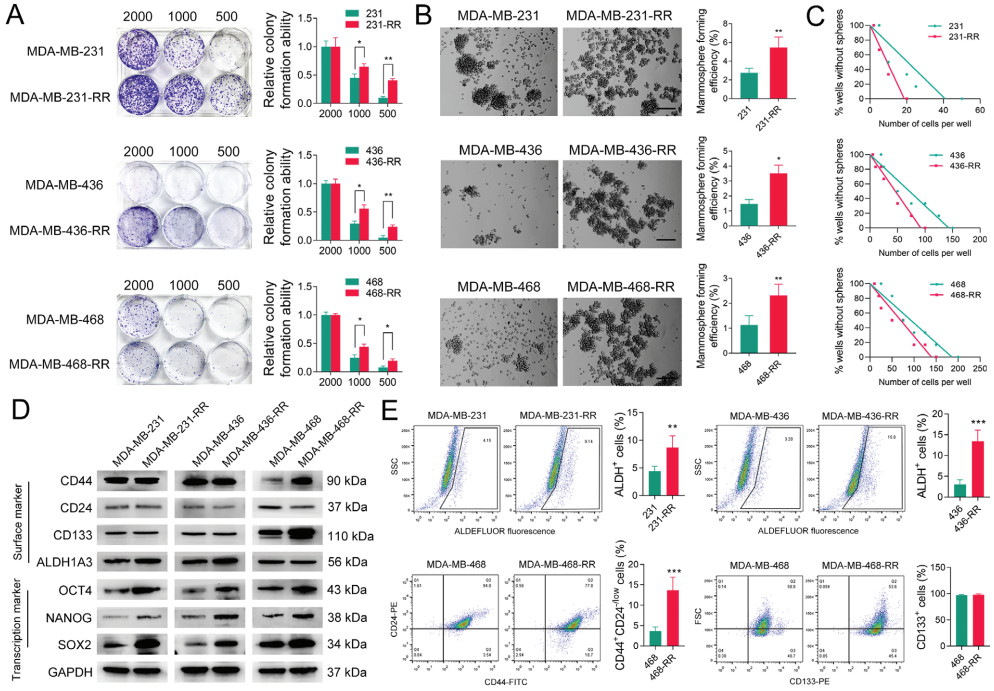
1、化疗耐受三阴性乳腺癌细胞中的干细胞样特性增强
考虑到肿瘤干细胞在治疗耐药中的作用,作者利用前期制备的化疗耐受三阴性乳腺癌细胞系研究了放射耐药表型的发展是否与三阴性乳腺癌的干性有关。利用有限稀释法进行克隆形成试验,作者发现当初始接种细胞数量减少时,放疗耐受的三阴性乳腺癌细胞可以形成比其亲代细胞更多的克隆。乳腺癌细胞微球体形成实验的结果表明,化疗耐受的三阴性乳腺癌细胞中形成的乳腺癌细胞微球体比亲代细胞多。与此一致的是,乳腺癌细胞微球体形成试验的极限稀释分析表明,产生一个球体所需的化疗耐受三阴性乳腺癌细胞的数量远少于亲代细胞,这表明化疗耐受的三阴性乳腺癌细胞具有更高的乳腺癌细胞微球体形成效率。CD44、CD24、CD133和ALDH1A3是三阴性乳腺癌肿瘤干细胞的重要表面标志物。OCT4、NANOG和SOX2被认为是维持肿瘤干细胞群体的重要转录标记物。因此,这些肿瘤干细胞标记物的表达也被用来评估化疗耐受三阴性乳腺癌细胞的干性。分析结果表明,这些标记物在不同的三阴性乳腺癌细胞系间表现出异质性表达的特点。ALDH1A3仅在MDA-MB-231-RR和436-RR细胞中表达上调,而CD44和CD133仅在MDA-MB-468-RR细胞中表达上调,MDA-MB-468-RR细胞中CD24的表达较亲本细胞下调。值得注意的是,维持干细胞多能表型的关键分子:OCT4, NANOG和SOX2,在三种化疗耐受三阴性乳腺癌细胞株中的表达显著上调。流式细胞术进一步研究发现,与亲本细胞相比,MDA-MB-231-RR和436-RR细胞中ALDH+细胞富集,MDA-MB-468-RR细胞中CD44+CD24−/low细胞富集,表明化疗耐受三阴性乳腺癌细胞中肿瘤干细胞群体扩大。
2、THOC2和THOC5在三阴性乳腺癌细胞中表达上调且与患者预后不良相关
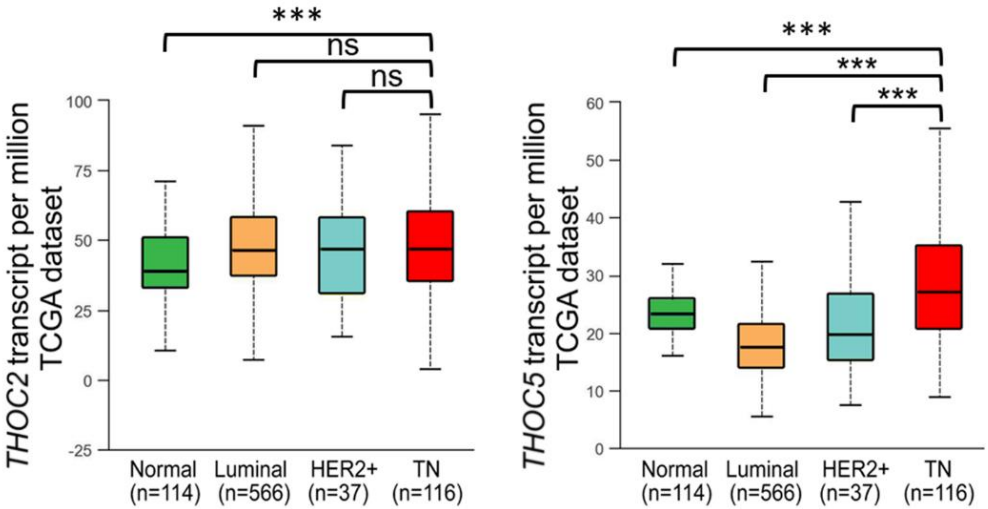
THOC2和THOC5在调节干细胞表型中都发挥着关键作用。作者采用qRT-PCR和WB检测了三阴性乳腺癌细胞株中THOC2、THOC5的mRNA和蛋白表达,结果表明,与亲本细胞相比,THOC2和THOC5在化疗耐受三阴性乳腺癌细胞的mRNA和蛋白水平均上调。因此,作者接下来分析了几个在线人类癌症组织数据集,包括:TCGA和CPTAC,发现与正常乳腺组织相比,三阴性乳腺癌组织中THOC2和THOC5在mRNA和蛋白水平上的表达均上调,THOC5上调更加明显。为了进一步确定THOC2和THOC5在人体组织中的表达,作者采用免疫组化(IHC)方法检测三阴性乳腺癌组织芯片(TMA)中THOC2和THOC5蛋白的水平。结果表明,三阴性乳腺癌组织中THOC2和THOC5的蛋白表达水平较配对癌旁组织明显升高。

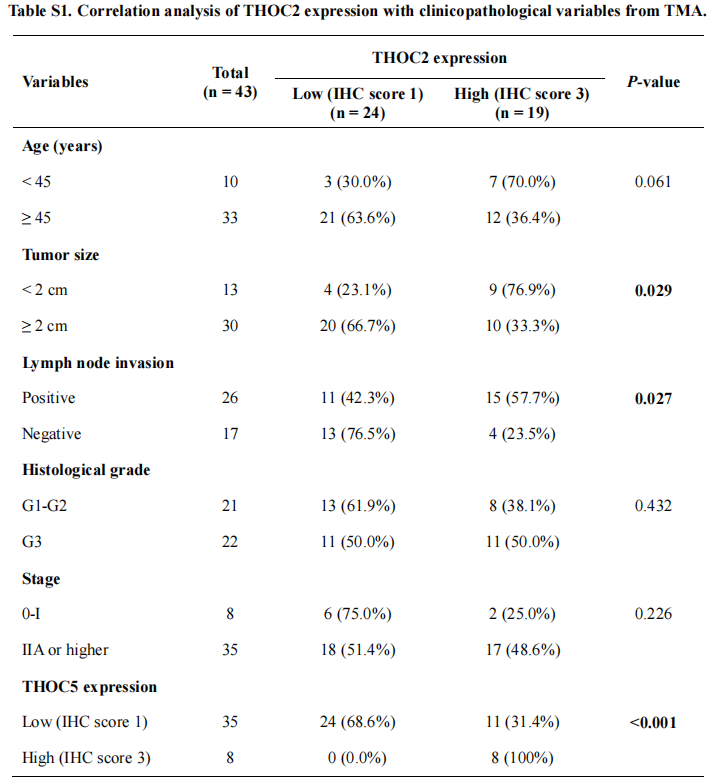
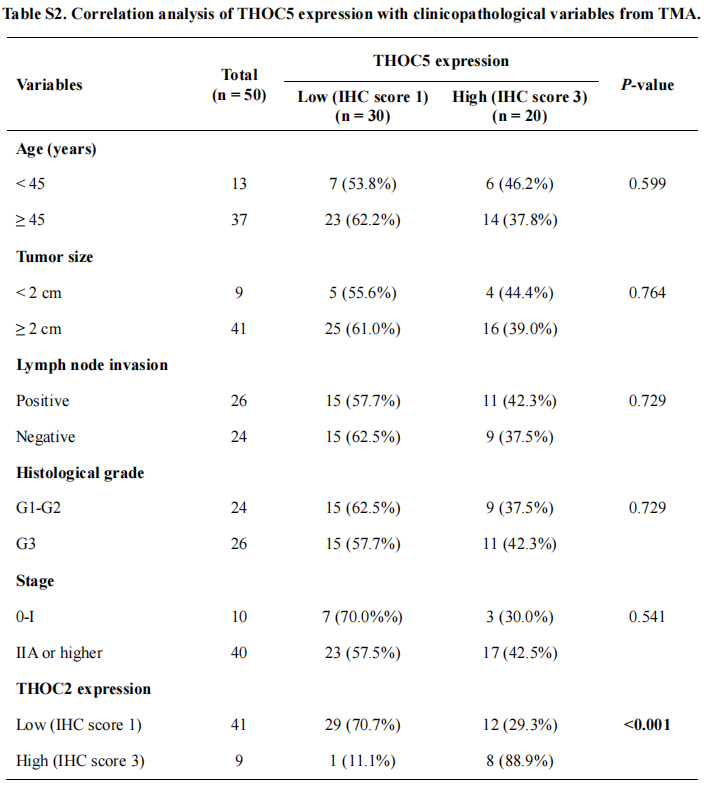
为了探讨THOC2和THOC5在三阴性乳腺癌中的临床意义,作者对组织芯片的IHC评分进行了生存分析。分析表明,THOC2或THOC5强染色(IHC评分=3)患者的总生存(OS)率远低于弱染色(IHC评分=1)患者。THOC2、THOC5的表达与患者临床病理变量的相关性分析显示,THOC2高表达与肿瘤体积增大(p=0.029)、淋巴结浸润(p=0.027)相关。此外,多因素分析显示,THOC2和THOC5表达均是总生存的独立预后因素(p分别为0.028和0.037)。通过分析已发表的包含患者生存和瘤内蛋白质组学的数据库,作者发现THOC2在肿瘤中较高的蛋白表达与三阴性乳腺癌患者较低的总生存率相关;THOC5与乳腺癌的较低的总生存率相关,但并不显著。此外,METABRIC数据集的分析显示,肿瘤内THOC2基因的高表达与乳腺癌和三阴性乳腺癌患者预后较差显著相关,而THOC5与生存无关。这些结果提示,THOC2和THOC5的表达与三阴性乳腺癌的化疗耐受有关,并可能在三阴性乳腺癌的进展中起重要作用。

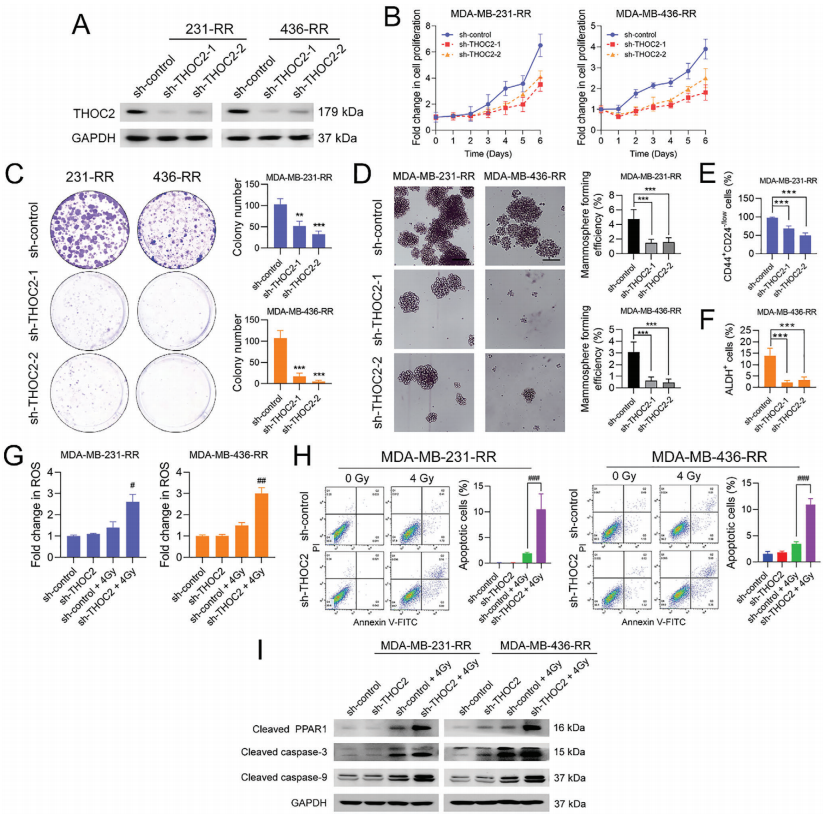
3、THOC2的表达敲除降低了化疗耐受三阴性乳腺癌细胞的干性并导致其放疗敏感
基于以上发现,作者决定探索THOC2的表达抑制是否可以改变化疗耐受三阴性乳腺癌细胞的辐射响应。靶向THOC2的不同转录本,作者设计了两种shRNA来降低THOC2的表达。Western blotting结果显示,两种特异性shRNA显著降低了MDA-MB-231-RR和436-RR细胞中THOC2的蛋白表达。THOC2的表达抑制显著影响了化疗耐受三阴性乳腺癌细胞的增殖,以及它们的克隆形成能力。此外,乳腺癌细胞微球体形成实验表明,THOC2的表达抑制显著干扰了乳腺癌细胞微球体的形成效率。流式细胞术进一步研究发现,THOC2表达敲除显著降低了MDA-MB-231-RR细胞中CD44+CD24−/low细胞的百分比,以及MDA-MB-436-RR细胞中ALDH+细胞的百分比。 为了评估THOC2的表达抑制对放射敏感性的影响,作者在抑制THOC2的表达后,用0或4 Gy的IR处理化疗耐受三阴性乳腺癌细胞。结果表明,THOC2的表达抑制显著增加了MDA-MB-231-RR和436-RR细胞中IR诱导的细胞内活性氧(ROS)积累。此外,THOC2基因敲除联合IR引起的化疗耐受三阴性乳腺癌细胞凋亡比IR单独引起的细胞凋亡更多。为了进一步确定THOC2的表达敲除对IR诱导的凋亡的影响,作者评估了线粒体凋亡信号的状态。结果表明,单独THOC2表达抑制并没有激活凋亡信号,而当暴露于4gy IR时,与对照组相比,THOC2的表达抑制显著增加了化疗耐受三阴性乳腺癌细胞中PARP1、caspase-3和caspase-9的蛋白表达。这些数据提示,THOC2的表达抑制可以降低化疗耐受三阴性乳腺癌细胞的干性,恢复其对IR的敏感性。此外,THOC2基因敲低还可使三阴性乳腺癌细胞对顺铂和阿霉素敏感。

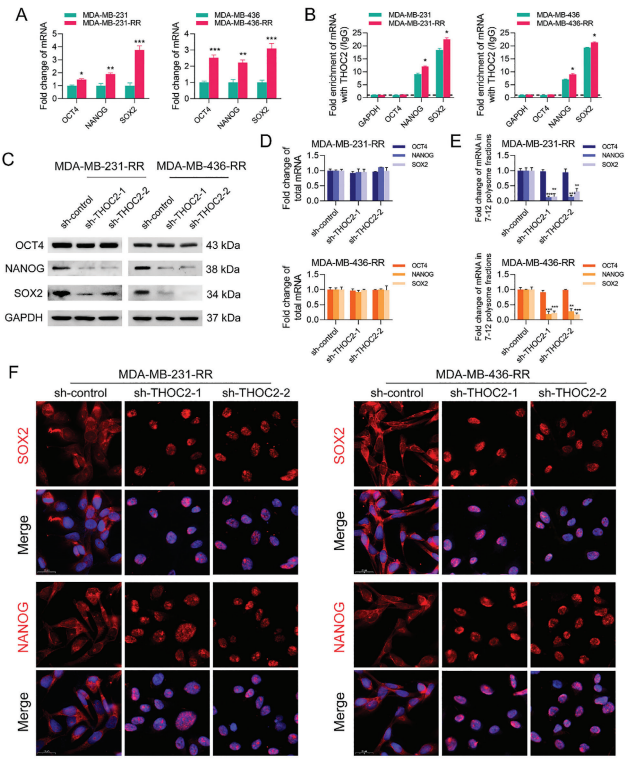
4、THOC2的表达敲除通过阻断SOX2和NANOG的转录本输出从而降低其蛋白表达
作者检测到在放疗耐受三阴性乳腺癌细胞中OCT4、NANOG和SOX2的mRNA表达上调。在小鼠胚胎干细胞中,THOC控制多能性基因转录本的核输出,作者考虑到THOC2作为THOC的支架,是否在人类三阴性乳腺癌中发挥类似的作用。因此,作者首先使用针对THOC2的抗体进行RNA免疫沉淀(RIP)检测,并分析与THOC2免疫共沉淀的mRNA。结果表明,THOC2在人三阴性乳腺癌细胞中与NANOG和SOX2的mRNA结合活性较高,化疗后这种相互作用进一步增强;相比之下,OCT4和GAPDH转录本没有被下拉。这些数据表明,THOC2可以直接与NANOG和SOX2转录本结合。为了进一步揭示THOC2与多能性因子表达的内在联系,作者进行了WB分析,发现THOC2损耗显著降低了放疗耐受三阴性乳腺癌细胞中的NANOG和SOX2蛋白表达,但不影响OCT4蛋白表达。值得注意的是,虽然NANOG和SOX2的总mRNA表达没有受到THOC2表达沉默的影响,但THOC2缺失后,它们在7-12多核糖体部分的mRNA水平显著下降。为了确定THOC2敲低是否通过阻碍TNBC中转录本的释放而降低多能性因子的表达,接下来,作者进行了RNA荧光原位杂交(FISH)试验,发现THOC2的表达敲除导致SOX2和NANOG转录本主要聚集在细胞核中,而对照组的转录本主要聚集在细胞质中。OCT4转录本不受THOC2表达敲除的影响。这些结果提示,THOC2可能通过控制多能性基因的核转录本输出来调控三阴性乳腺癌细胞的干细胞活性。
5、THOC5是THOC2介导的放疗耐受TNBC细胞的干性增强所必需的
已有文献表明,THOC5是多能性基因转录本的THOC特异性调配亚基,在本研究中,作者发现THOC2敲低可降低化疗耐受三阴性乳腺癌细胞中THOC5的蛋白表达。为了证实THOC5在调控三阴性乳腺癌干性中的作用,作者使用针对THOC5的抗体进行了RIP试验。结果显示,NANOG和SOX2的mRNA与THOC5免疫共沉淀,化疗后 结合活性进一步增强。这些数据表明,THOC5可以直接与NANOG和SOX2转录本结合。接下来,作者使用两种不同的shRNA在MDA-MB-231-RR和436-RR细胞中使THOC5的表达沉默。与THOC2敲除类似,THOC5的敲除可显著降低化疗耐受三阴性乳腺癌细胞中NANOG和SOX2的蛋白表达。通过乳腺癌细胞微球体实验进一步研究表明,THOC5沉默显著降低了化疗耐受三阴性乳腺癌细胞的球体形成能力。THOC5的表达敲除使MDA-MB-231-RR细胞中CD44+CD24−/low细胞的百分比,以及MDA-MB-436-RR细胞中ALDH+细胞百分比显著降低。 此外,THOC5缺失显著降低了NANOG和SOX2的7-12多核糖体部分的mRNA表达量,但不影响其总mRNA表达量。为了确定THOC5是否介导三阴性乳腺癌细胞中NANOG和SOX2转录本的核输出,作者进行了RNA-FISH检测,并分析了THOC5敲低后,NANOG和SOX2的mRNA的亚细胞分布。结果表明,THOC5的表达沉默显著抑制了NANOG和SOX2 mRNA从细胞核向细胞质的输出。此外,通过RIP实验,作者观察到,THOC5的表达沉默可以消除THOC2与化疗耐受三阴性乳腺癌细胞中的NANOG或SOX2 mRNA的结合。这些结果表明,THOC5在维持肿瘤干细胞特性中起着重要作用;在三阴性乳腺癌细胞中,THOC5是THOC2与多能性基因转录本的相互作用所必需的。

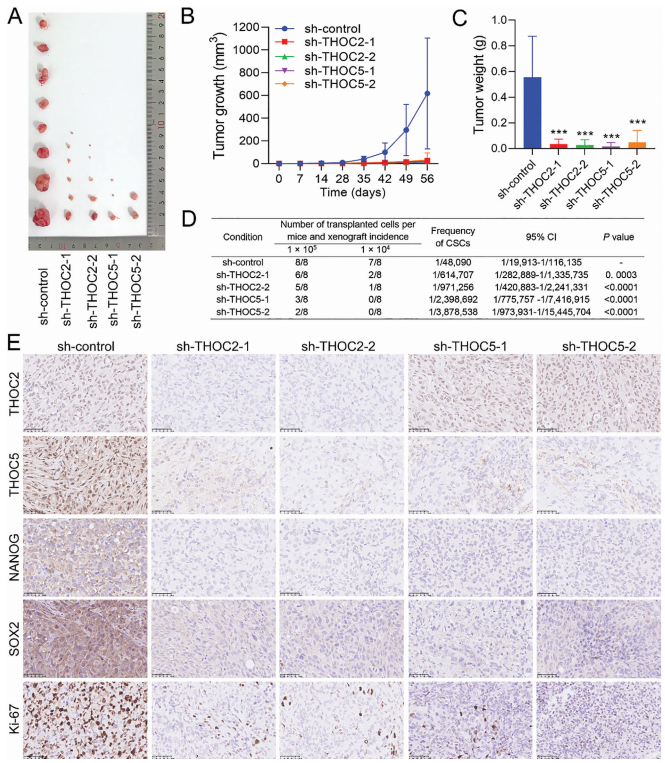
6、THOC2或THOC5的基因敲除抑制了化疗耐受TNBC的体内致瘤性
为了确定THOC2或THOC5的表达缺失对化疗耐受三阴性乳腺癌致瘤能力的影响,作者在裸鼠皮下植入表达sh-control、sh-THOC2或sh-THOC5的MDA-MB-231-RR细胞,建立移植瘤模型进行了体内实验。结果表明,与对照组相比,THOC2或THOC5的表达敲除显著降低了MDA-MB-231-RR细胞产生的肿瘤数量和大小,并影响其生长;sh-THOC2组和sh-THOC5组的肿瘤生长速度比对照组慢,实验结束时肿瘤的重量也轻很多。用极限稀释法分析体内肿瘤发生率,发现THOC2和THOC5缺失组的肿瘤干细胞比率远低于对照组。进一步对异种移植瘤进行免疫组化分析发现,THOC2或THOC5的表达敲除显著降低了肿瘤内THOC2或THOC5的蛋白水平,NANOG和SOX2的蛋白表达也随之降低。此外,在异种移植瘤中,THOC2和THOC5组的ki-67阳性细胞显著减少。这些数据表明,THOC2或THOC5的表达缺失可在体内抑制化疗耐受三阴性乳腺癌的致瘤性和肿瘤生长。
7、THOC5的基因敲除可恢复TNBC细胞的放射敏感性
与体内实验结果一致,细胞增殖实验结果表明,THOC5的表达沉默抑制了MDA-MB-231-RR和436-RR细胞的增殖。细胞周期分析结果表明,THOC5的表达沉默阻断了放疗耐受三阴性乳腺癌细胞的细胞周期进程,细胞周期阻滞在G2/M期,这是DNA损伤的关键检查点。 接下来,作者考虑到THOC5的表达敲除是否能恢复三阴性乳腺癌的放射敏感性。因此,作者首先利用流式细胞术评估了THOC5的表达敲除对IR前后细胞内ROS水平的影响。结果表明,THOC5表达沉默并不影响IR缺失时ROS的产生,而在MDA-MB-231-RR和436-RR细胞中,THOC5表达沉默显著增加了4Gy IR诱导的细胞内ROS积累。TUNEL可原位检测细胞凋亡过程中的DNA断裂,是评估IR损伤的一种合适方法。通过TUNEL实验,作者观察到,THOC5表达沉默结合4Gy IR显著增加了DNA断裂,这从化疗耐受三阴性乳腺癌中TUNEL+细胞的增加可以看出。没有IR时,sh-control组和sh-THOC5组TUNEL+细胞百分率无明显差异。这些结果表明THOC5的消耗可以逆转三阴性乳腺癌的抗辐射能力。此外,THOC5基因敲低还增加了化疗耐受三阴性乳腺癌细胞对顺铂和阿霉素的敏感性。

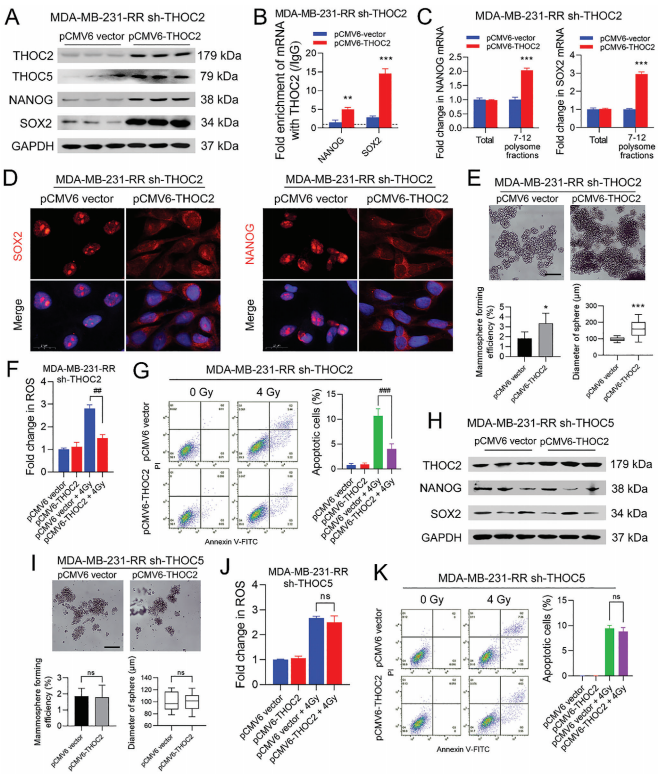
8、THOC2以THOC5依赖的方式促进了三阴性乳腺癌细胞的干性和放疗耐受
为了进一步验证THOC2在维持三阴性乳腺癌干性中的重要性,作者使用THOC2过表达质粒(pCMV6-THOC2)在THOC2表达缺失的MDA-MB-231-RR细胞中恢复THOC2的表达。WB分析结果表明,转染pCMV6-THOC2质粒可恢复THOC2、NANOG和SOX2蛋白在THOC2表达缺失的MDA-MB-231-RR细胞中的表达。进一步的RIP分析数据表明,THOC2与NANOG和SOX2 mRNA的结合活性通过THOC2的表达挽救而恢复;THOC2表达缺失的MDA-MB-231-RR细胞中,7-12多聚核糖体部分的NANOG和SOX2 mRNA表达也增加。与对照组相比,在THOC2表达恢复后,SOX2和NANOG转录本主要集中在细胞质中。同时,THOC2表达恢复后,THOC2表达沉默的MDA-MB-231-RR细胞的成球能力明显恢复。为了进一步验证THOC2在维持三阴性乳腺癌化疗耐受中的重要性,作者在THOC2挽救实验后,评估了THOC2表达沉默的MDA-MB-231-RR细胞对IR诱导的氧化应激和凋亡的敏感性。结果表明,与对照组相比,pCMV6-THOC2质粒对THOC2的表达恢复显著降低了4gy IR诱导的细胞内ROS积累和细胞凋亡。 为了进一步验证THOC5相对于THOC2的重要性,作者使用pCMV6-THOC2质粒上调THOC2在THOC5表达缺失的MDA-MB-231-RR细胞中的表达,并评估其对干性和放射敏感性的影响。WB分析结果显示,THOC2的过表达没有改变NANOG和SOX2的蛋白表达。同时,在THOC5表达缺失的MDA-MB-231-RR细胞中,THOC2的过表达也未能恢复其乳腺球形成能力。此外,在THOC5表达缺失的MDA-MB-231-RR细胞中,THOC2的表达上调并没有降低4Gy IR引起的细胞内ROS水平和凋亡细胞百分比。这些数据表明,THOC2通过THOC5依赖的方式调节多能性基因转录本,在维持三阴性乳腺癌的干性和放射敏感性方面发挥关键作用。
研究结论
在本研究中,作者发现肿瘤干细胞在化疗耐受的三阴性乳腺癌细胞中富集,同时在这些细胞中也发现THOC2和THOC5的高表达,并与三阴性乳腺癌患者的不良预后相关。进一步的研究发现,THOC2通过控制细胞核中SOX2和NANOG转录本的释放,以THOC5依赖的方式调控三阴性乳腺癌的肿瘤干性和放射敏感性。这些发现首次证明了THOC2和THOC5在调控肿瘤干性和放疗耐受方面的重要性,为复发性三阴性乳腺癌的治疗提出了新的治疗靶点及替代性治疗策略。
参考文献
Bai X, Ni J, Beretov J, et al. THOC2 and THOC5 Regulate Stemness and Radioresistance in Triple‐Negative Breast Cancer[J]. Advanced Science, 2021: 2102658.





