目前全世界约有20亿人感染乙型肝炎病毒,其中约3.5亿人为慢性乙型肝炎,仍是发展为肝硬化和肝细胞癌的高危人群。因此,乙肝病毒感染是一项重大的全球公共卫生挑战。HBV是嗜肝DNA病毒科的一种小型DNA病毒,其遗传物质为部分双链环状DNA,大小仅为3.2 kb。HBV基因组DNA侵入宿主细胞核后,转化为共价闭合环状DNA (cccDNA),聚集在细胞核中,形成核小体结构。cccDNA作为一种微型染色体,与HBV感染的持续性有关。它也构成了病毒mRNA转录模板,包括:编码不同形式的HBsAg(2.4 kb和2.1 kb);编码HBx蛋白质(0.7 kb)和两个比基因组长度还长的RNA(3.5 kb和3.6 kb),称为pgRNA和pcRNA。pgRNA可以被逆转录为松弛环状双链DNA (rcDNA),是病毒聚合酶(pol)和核心蛋白(HBc)翻译的模板。pcRNA比pgRNA长,可以指导preC蛋白的合成,preC蛋白是HBeAg的前体。
HBV感染是慢性肝炎、肝硬化和肝癌的一个关键风险因素。HBV相关肝癌的癌变机制和进展已经得到了广泛的研究。HBV通过直接和间接的机制促进肝癌的发展。它的DNA整合到宿主基因组中,可能导致克隆肿瘤的扩张和基因组不稳定,又或直接插入突变,最终导致肝癌。病毒蛋白(包括HBx和包膜蛋白)的延长表达构成了可能调控细胞死亡、增殖和信号通路的致癌因子。此外,HBx和HBc蛋白诱导了靶向抑癌基因表达的表观遗传修饰,以促进肝癌的发展。HBV也通过HBx表达激活端粒酶活性,而促进肝癌的发生。
HBV可能产生在肝癌进展中发挥重要作用的新分子,如:HBV可以编码miRNA(HBV-miR-2和HBV-miR-3)而促进肝癌发展。环状RNA(circRNAs)是一种通过反向剪接产生的闭合环状RNA。在古生菌、酵母、植物、无脊椎动物和脊椎动物中都发现了环状RNA。越来越多的证据表明环状RNA具有多种生物学功能,包括调节转录和剪接,海绵作用于miRNA和蛋白质,以及作为翻译模板。除了细胞环状RNA外,有报道称,γ疱疹病毒包括:EBV、rLCV、KSHV和MHV68可以产生环状RNA。最近,从HBV pgRNA中发现了circRNA。利用病毒感染相关RNA测序数据,研究人员鉴定出5个由HBV编码的环状RNA。然而,HBV编码的circRNA的生物学功能尚不清楚。
研究路线
研究内容
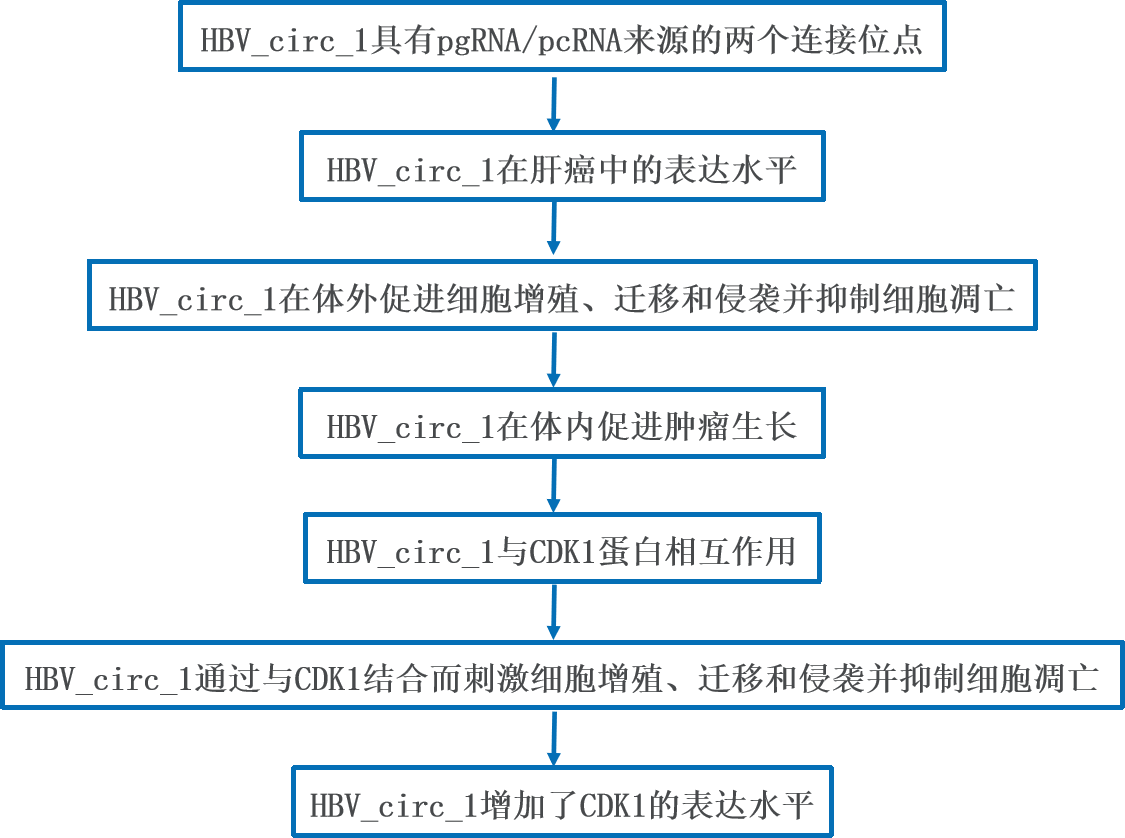
1、HBV_circ_1具有pgRNA/pcRNA来源的两个连接位点
作者之前对HBV阳性细胞系HepG2.2.15使用poly(A)+或RNase R消化的RNA文库进行了转录组测序。测序结果显示,一个名为HBV_circ_1的候选circRNA (2,497 bp)定位于HBV基因组的489-2,985nt区域(GenBank:KU668446.1)。 HBV转录开始于HBV cccDNA上不同的转录起始位点,而终止于一个共同的转录终止位点。已知HBV cccDNA可转录2.4 kb、2.1 kb、0.7 kb和3.5-3.6 kb的RNA。此外,只有2.4 kb、2.1 kb和0.7 kb的病毒RNA,具有与HBV基因组相对应的2986-488 nt区域的全部或部分序列,而非HBV_circ_1。因此,HBV_circ_1不是由2.4 kb、2.1 kb和0.7 kb的HBV RNA生成的。序列比对显示,HBV_circ_1由源于pgRNA/pcRNA的两个序列组成,一个对应于HBV基因组的489-1,932 nt区域,另一个对应于HBV基因组的1,933-2,985 nt区域。如下图所示,将HBV基因组2986-488 nt区域对应的序列从pgRNA/pcRNA中去除后,剩余的pgRNA/pcRNA序列形成了一个连接位点。特别是缺失的HBV pgRNA序列的前两个位置和后两个位置的双核甘酸分别为GU和AG,与内含子保守边界序列一致。序列分析显示,位于pgRNA/pcRNA的5'末端区域的113个碱基序列(对应于HBV基因组的1820-1932 nt区域)与pgRNA/pcRNA的3'末端序列重复。在去除位于5'和3'末端的非重复序列以及其中一个重复单元后,pgRNA/pcRNA的两端形成了另一个连接位点(连接位点A),从而证明HBV_circ_1具有两个连接位点。
逆转录可能会导致模板转换形成伪产物,RNase R不能消化全部线性RNA且会在转录中间停滞。因此,一些由不同计算工具预测的环状RNA可能是人为的。为了确认HBV_circ_1不是测序伪产物或噪音,作者从HBV阳性HepG2.2.15细胞中提取的RNA并经DNase I和RNase R消化后,使用Q-HBV_circ_1-Forward/Q-HBV_circ_1-Reverse引物进行RT-PCR,结果显示,RNA样本中扩增出了代表HBV_circ_1的PCR产物。PCR产物经Sanger测序得到与高通量测序相同的剪接连接位点B。连接位点A也经同样的方法进行了确认。此外,无论是否用RNase R处理,通过northern blotting在HBV阳性的HepG2.2.15细胞中都能观察到靶向连接位点B的特异性条带,而在HBV阴性的HepG2细胞中则观察不到。利用Primer2-Forward和Primer3-Reverse交叉连接位点A,Primer2-Reverse和Primer3-Forward交叉连接位点B进行PCR扩增,鉴定HBV_circ_1的全序列。从HBV阳性的HepG2.2.15细胞RNA中获得了特异性PCR产物,而从HBV阴性的HepG2细胞RNA中未获得特异性PCR产物,说明连接位点A和B在同一个分子上。回收的PCR产物进一步克隆到T载体中。

Sanger测序确定的HBV_circ_1序列与RNA_Seq测序结果一致。这些结果表明,HBV_circ_1具有pgRNA/pcRNA来源的两个连接位点,存在于HBV阳性HepG 2.2.15细胞中。为了证实HBV_circ_1是内源性的,作者使用组织芯片进行了原位杂交实验。结果表明,HBV_circ_1可以在HBV阳性组织中检测到,HBV_circ_1主要定位于细胞质中。这些结果表明HBV_circ_1是在体内产生的。
2、HBV_circ_1在肝癌中的表达水平
为了评估HBV_circ_1的表达水平是否与HBV相关肝癌有关,作者使用组织芯片,通过对68例肝癌组织和配对癌旁组织进行原位杂交检测来评估其在临床样本中的表达。统计结果显示,肿瘤组织中HBV_circ_1的表达水平明显高于癌旁组织。此外,作者发现HBV_circ_1阳性患者的生存率明显低于HBV_circ_1阴性患者。这些结果提示HBV_circ_1参与了肝癌的发生。

3、HBV_circ_1在体外促进细胞增殖、迁移和侵袭并抑制细胞凋亡
作者对肝癌细胞株HepG2、SMMC-7721和正常肝细胞株AML-12,采用MTT法评价HBV_circ_1对细胞增殖的影响。结果表明,HBV_circ_1的瞬时表达可诱导细胞增殖。HBV_circ_1瞬时表达组中,检测到HepG2、SMMC-7721和AML-12细胞在G1期的比例分别为47.74%、60.6%和38.1%,而对照组分别为52.75%、63.84%和47.7%。HepG2、SMMC-7721、AML-12细胞处于G2/S期的比例增加,提示了细胞周期加快。
流式细胞术检测了HBV_circ_1对细胞凋亡的影响。结果表明,与对照细胞相比,HBV_circ_1的瞬时表达可抑制HepG2和AML-12细胞的早期凋亡;瞬时表达HBV_circ_1组早期凋亡的HepG 2细胞比例为1.79%,对照组为11.02%;而HBV_circ_1对AML-12细胞凋亡无明显影响。这些数据表明,HBV_circ_1抑制HepG2细胞的早期凋亡。此外,Boyden小室和transwell实验结果表明,HBV_circ_1促进了HepG2和AML-12细胞的迁移和侵袭。

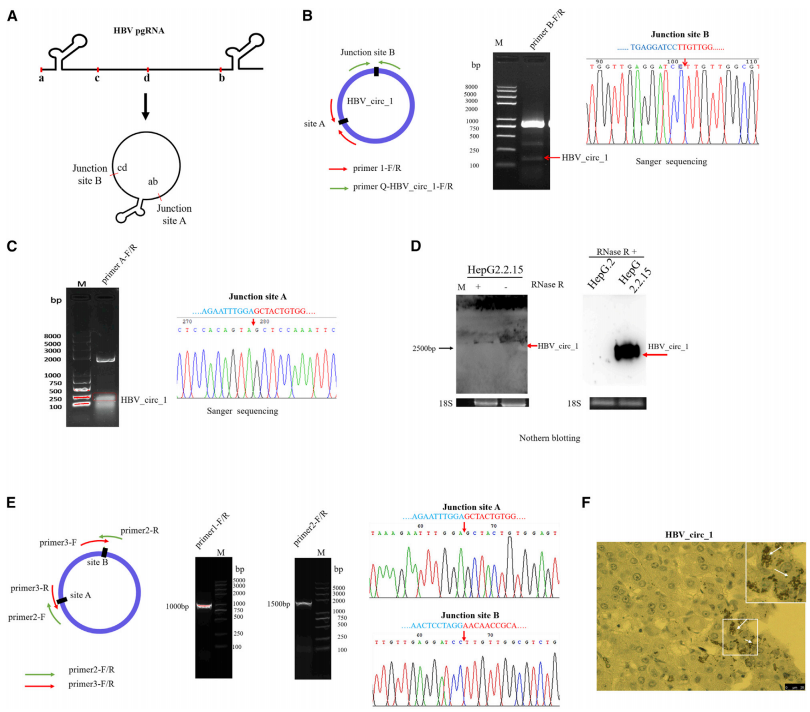
4、HBV_circ_1在体内促进肿瘤生长
为了进一步探讨HBV_circ_1在体内肿瘤发生中的作用,作者将转染了pLCDH-HBV_circ_1或pLCDH空载体的SMMC-7721细胞注射到BALB/c裸鼠的背侧。接种6周后,作者对动物实施安乐死并手术切除皮下肿瘤。结果表明,转染pLCDH-HBV_circ_1组的肿瘤生长速度快于空载对照组。此外,通过PCR和Sanger测序在形成的肿瘤中检测到了HBV_circ_1。接着进行H&E染色,以确定HBV_circ_1对肿瘤发展的影响。结果表明,HBV_circ_1瞬时表达的肿瘤细胞结构异常,排列紊乱。与对照组相比,肿瘤恶性程度更高。核蛋白Ki67被广泛用作肿瘤细胞增殖和生长的增殖标志物,而cyclin D1在肿瘤发生过程中调控G1/S期转变。为了评估HBV_circ_1在促进细胞增殖和细胞周期中的作用,作者通过免疫组化检测肿瘤组织中Ki67和cyclin D1的表达水平。结果显示,与对照组相比,它们的表达增加,说明HBV_circ_1促进了肿瘤的生长。
5、HBV_circ_1与CDK1蛋白相互作用
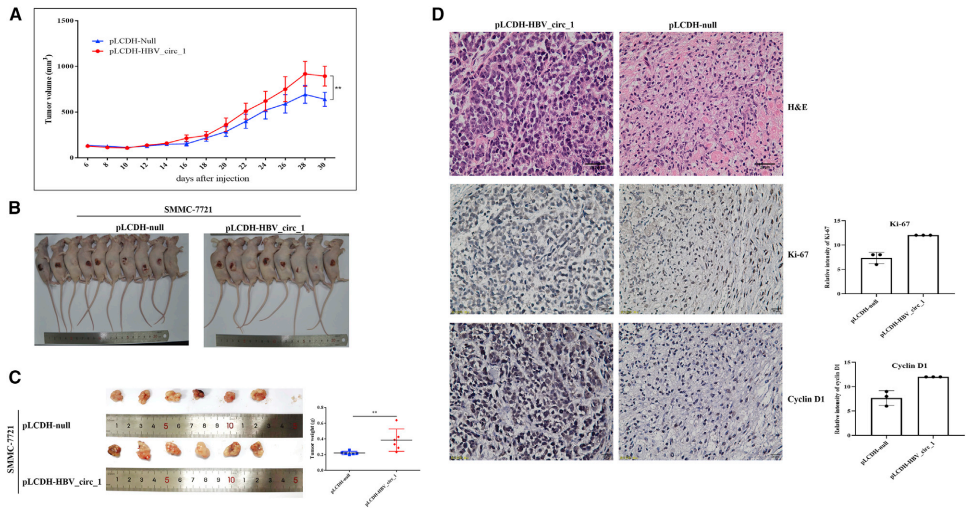
为了探究HBV_circ_1是否与蛋白相互作用而调控细胞周期,作者将生物素标记的HBV_circ_1和生物素标记的环状绿色荧光蛋白基因序列(circ_gfp)进行RNA pull-down实验。通过SDS-聚丙烯酰胺凝胶电泳(SDS- page)分离沉淀复合物,与生物素标记的circ_gfp的相比,生物素标记的HBV_circ_1中存在特异性的蛋白条带。蛋白条带回收并进行质谱鉴定,共鉴定出13个蛋白,包括CDK1、CDK18、PHB和剪接因子U2AF35。CDK1和CDK18蛋白均与细胞周期相关。

为进一步验证蛋白与HBV_circ_1的相互作用,作者使用CDK1抗体进行RNA免疫沉淀(RIP)实验。沉淀复合物提取RNA,逆转录为cDNA后,进行PCR检测HBV_circ_1水平。结果显示,CDK1抗体对HBV_circ_1的富集水平明显高于对照组。同样的策略也用于评估PHB和U2AF35对HBV_circ_1的富集水平。结果表明,HBV_circ_1可以被PHB和U2AF35富集。细胞免疫荧光实验显示,HBV_circ_1与CDK1共同定位于细胞核。此外,western blotting检测到HBV_circ_1的RNA pull-down沉淀复合物中存在CDK1,进一步证实HBV_circ_1与CDK1蛋白相互作用。然而,HBV_circ_1是直接还是间接地与CDK1结合?作者利用大肠杆菌表达CDK1重组蛋白,并纯化CDK1重组蛋白进行EMSA和RIP实验。RIP实验结果显示,CDK1抗体能富集HBV_circ_1。EMSA结果也显示重组CDK1蛋白与HBV_circ_1结合,提示HBV_circ_1直接与CDK1结合。因此,作者推测可能是HBV_circ_1通过与CDK1结合而调控细胞表型特征。
6、HBV_circ_1通过与CDK1结合而刺激细胞增殖、迁移和侵袭并抑制细胞凋亡
在本研究中,作者利用http://s.tartaglialab.com/page/catrapid_group网站预测了CDK1和HBV_circ_1的结合位点,然后根据预测的结果,构建了CDK1和HBV_circ_1结合位点缺失的HBV_circ_1-mut。为了证明HBV_circ_1通过结合CDK1而调控细胞表型特征,作者在肝癌细胞株HepG2和正常肝细胞株AML-12中通过MTT实验评估了HBV_circ_1或HBV_circ_1-mut对细胞增殖的影响。结果显示,与HBV_circ_1相比,HBV_circ_1-mut组细胞增殖减少。此外,作者发现当CDK1表达沉默时,HBV_circ_1对细胞增殖的影响减弱。细胞周期实验显示,G1期的AML-12细胞在HBV_circ_1-mut瞬时表达组比例为56.25%,在CDK1表达沉默组的比例为39.62%,而在HBV_circ_1组的比例为39.27%。G2/S期的AML-12细胞比例减少,提示HBV_circ_1不能与CDK1结合时,细胞周期减慢。而流式细胞分析结果显示,与HBV_circ_1相比,HBV_circ_1-mut瞬时表达及CDK1表达沉默后AML-12细胞早期凋亡略有增加。Boyden小室和transwell实验也表明,在HepG2和AML-12细胞中,当HBV_circ_1-mut瞬时转染和CDK1表达沉默时,HBV_circ_1促进细胞迁移和细胞侵袭的作用减弱。这些结果表明,HBV_circ_1通过与CDK1结合促进细胞增殖、迁移和侵袭,抑制细胞凋亡。
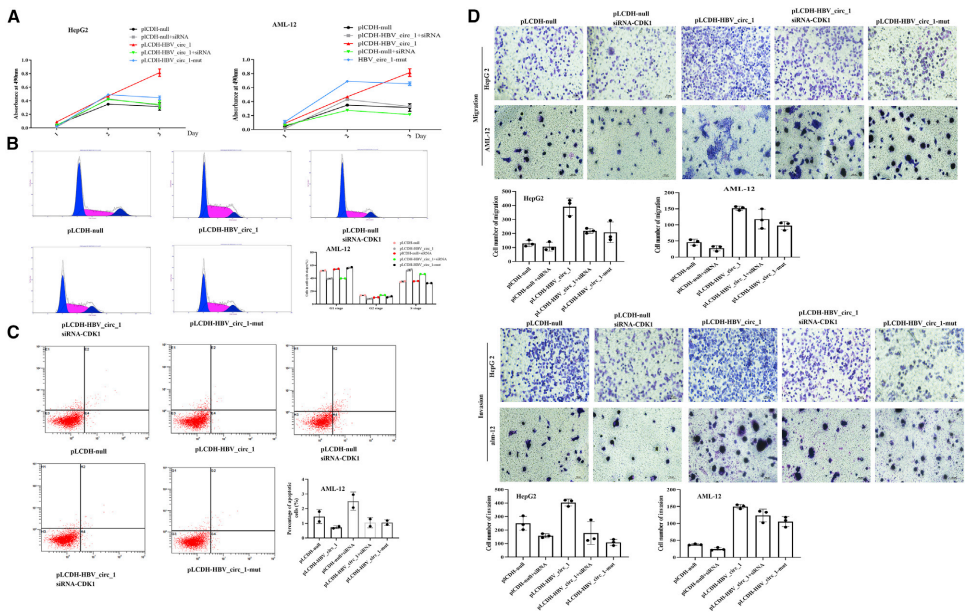
7、HBV_circ_1增加了CDK1的表达水平
研究表明,cyclin和CDKs的异常表达导致细胞周期紊乱,细胞增殖失控,最终发生癌变。CDK1是一种与cyclin结合并激活细胞周期进程的蛋白激酶。在减数分裂和有丝分裂中,它也是驱动M期的关键。作者进一步采用real-time PCR和western blot检测HBV_circ_1是否改变CDK1的表达水平。结果表明,在瞬时表达HBV_circ-1的细胞中,CDK1表达显著增加。此外,免疫组化检测HBV_circ_1瞬时表达的肿瘤中CDK1表达水平较对照组明显升高,提示HBV_circ_1在体内外均增加了CDK1表达。Boyden小室和transwell实验进而表明,由于CDK1的表达沉默, HepG2细胞和AML-12细胞的细胞迁移和细胞侵袭被抑制。然而,HBV_circ_1的瞬时表达可以挽救HepG2和AML-12细胞的迁移和侵袭,提示HBV_circ_1可能通过改变CDK1的表达水平来调控细胞表型特征。

研究结论
本研究在HBV阳性的HepG2.2.15细胞和HBV相关的肝癌组织中发现了HBV编码的一种新型环状RNA:HBV_circ_1。作者发现HBV_circ_1增强了细胞增殖、迁移和侵袭;体外抑制细胞凋亡;体内增加肿瘤大小;并与周期蛋白依赖性激酶1(CDK1)相互作用。这表明HBV_circ_1与CDK1的相互作用可能促进肝癌的进展。作者的发现为了解HBV肝癌的发生提供了新的线索,也为开发HBV相关肝癌治疗药物提供了新的靶点。
参考文献
Min Zhu, Zi Liang, Jun Pan, Xing Zhang, Renyu Xue, Guangli Cao, Xiaolong Hu, Chengliang Gong,
Hepatocellular carcinoma progression mediated by hepatitis B virus-encoded circRNA HBV_circ_1 through interaction with CDK1, Molecular Therapy - Nucleic Acids, Volume 25, 2021, Pages 668-682, ISSN 2162-2531, https://doi.org/10.1016/j.omtn.2021.08.011.





