食管鳞状细胞癌(ESCC)是世界上第九大最常见的恶性肿瘤,也是导致癌症相关死亡的第六大原因。由于ESCC具有较强的侵袭转移能力,大多数患者在初诊时已处于肌层深部浸润、淋巴结转移或邻近器官转移的晚期,故而预后较差。ESCC患者的5年生存率(20%)在过去十年中一直很低。因此,研究ESCC侵袭和转移的分子机制有助于提高我们对这种疾病的了解,进而开发新的有前途的生物标记物和治疗靶点。
BACH1属于CNC转录因子家族。BACH1的功能结构包括:N端BTB/POZ结构域(与蛋白质相互作用)和C端bZIP结构域(与DNA结合)。BACH1广泛存在于哺乳动物的各种组织中,已被证明是一种转录因子,通过激活或抑制靶基因的转录而发挥作用。BACH1作为抗氧化基因HMOX-1的转录抑制因子,在多种人类细胞中参与氧化应激。另外,BACH1也被报道参与了多种细胞和组织的细胞周期、造血、血管生成和免疫过程。
最近,越来越多的证据表明BACH1在许多实体肿瘤中高表达。在乳腺癌、结直肠癌、前列腺癌、卵巢癌、胰腺癌、骨肉瘤和肺癌中,BACH1的异常表达有助于肿瘤转移。一些研究表明,BACH1是癌症进展和转移的主要转录调控因子。例如,在RAS驱动的胰腺导管腺癌中,BACH1直接抑制了转录因子FOXA1(可以激活CDH1、CLDN3和CLDN4)的表达,从而诱导EMT和肿瘤转移;BACH1还通过激活一些转移基因(包括MMP1和CXCR4)的转录,作为乳腺癌骨转移的关键调控因子;此外,在人类卵巢癌中,BACH1通过与HMGA2相互作用并增强包括:VIM、SNAI1和SNAI2在内的EMT基因的转录而促进肿瘤迁移;在肺癌中,BACH1的表达通过激活HK2的转录来刺激糖酵解,并触发糖酵解依赖性肺癌转移。虽然BACH1已被报道为多种癌症转移的关键调控因子,但其在ESCC中的作用仍不清楚。
研究路线
1、BACH1在ESCC组织中高表达且与预后不良有关
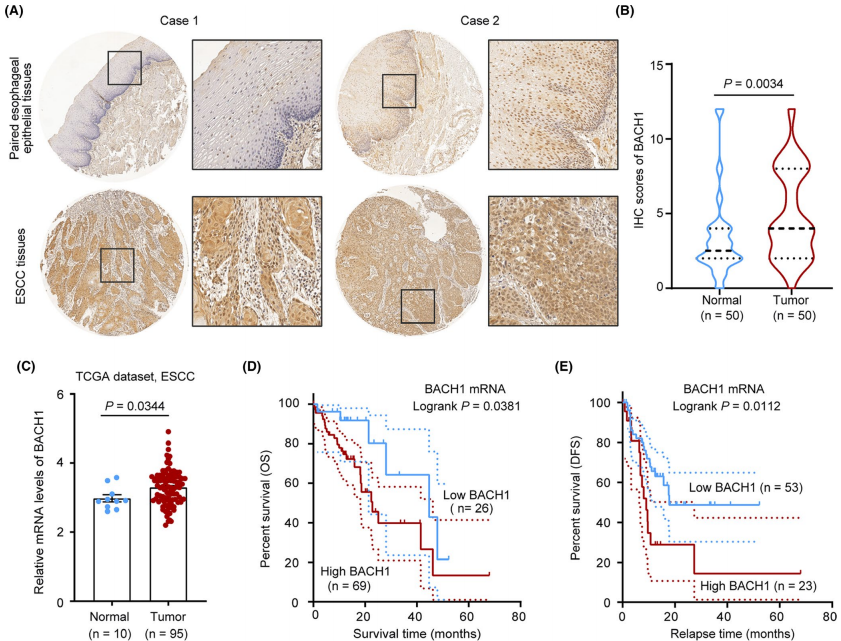
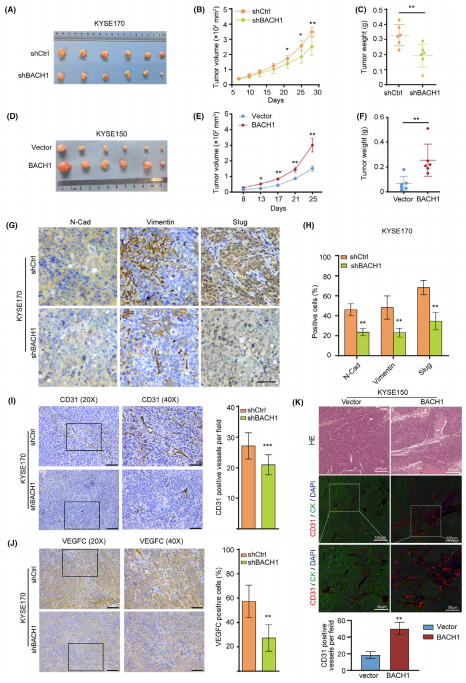
为了探讨BACH1在食管鳞癌中的临床意义,作者采用免疫组化方法检测了BACH1在50例食管鳞癌组织及配对食管上皮组织中的表达。结果显示,BACH1在癌旁组织中表达弱或中等,在癌组织中表达中等或强。统计学分析表明,BACH1在ESCC组织中的IHC评分明显高于癌旁组织(P=0.0034)。作者接下来分析了TCGA数据库中ESCC组织数据集,结果显示,BACH1的mRNA表达水平在ESCC组织中的平均表达量显著高于癌旁组织(P=0.0344)。然后,作者基于TCGA-ESCC数据库分析了BACH1的mRNA表达水平与生存时间的关系。结果显示,与低表达组相比,高表达组患者的OS较差(P=0.0385), DFS较短(P=0.0112)。总之,这些数据表明,BACH1可能在ESCC的进展中起关键作用。
2、BACH1在食管鳞癌细胞中的表达
作者使用Western blot和qPCR测定了BACH1在4种ESCC细胞系中的表达情况,结果表明,BACH1在KYSE30和KYSE170细胞中表达量较高,在KYSE150和KYSE510细胞中表达量较低;IF分析结果显示,BACH1表达定位于ESCC细胞的细胞核和细胞质中。因此,作者在KYSE30和KYSE170细胞中,使用两个siRNA对BACH1进行瞬时敲除;构建了BACH1稳定过表达的KYSE150细胞系,以及BACH1稳定敲除的KYSE170细胞系,来研究和验证BACH1的长期作用。作者通过qPCR和Western blot分析分别验证了BACH1基因的敲除和过表达效率。

3、BACH1增强了ESCC细胞在体外的迁移和侵袭能力
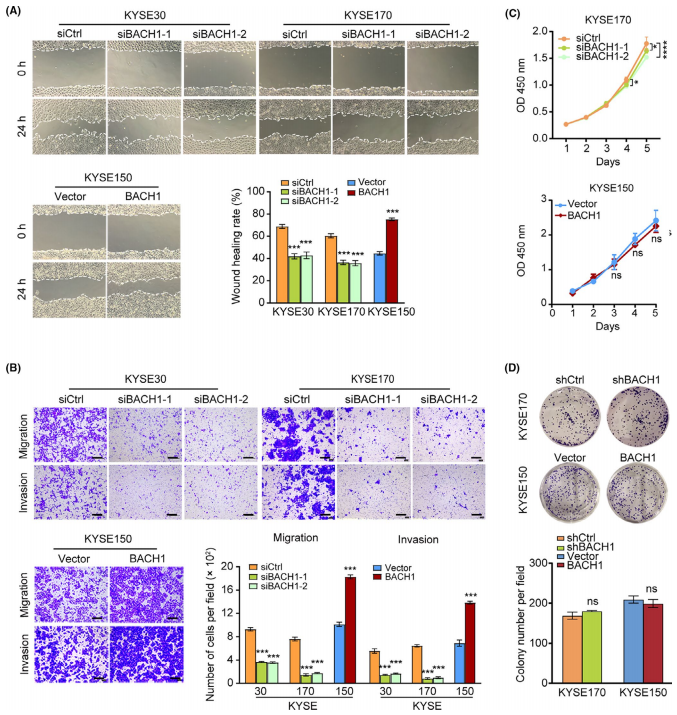
为了确定BACH1在ESCC中的功能作用,作者采用体外伤口愈合和Transwell实验检测了BACH1对ESCC细胞侵袭和迁移能力的影响。伤口愈合实验结果显示,BACH1的过表达显著增加了KYSE150细胞的迁移,而BACH1的敲除显著降低了KYSE30和KYSE170细胞的迁移。Transwell实验的结果表明,BACH1的过表达显著促进了KYSE150细胞的迁移和侵袭,而BACH1在KYSE30和KYSE170细胞的表达敲除抑制了细胞的迁移和侵袭,这些结果证实了BACH1在体外对ESCC细胞也有促进侵袭和转移的影响。随后,作者通过CCK和集落形成实验检测了BACH1对细胞短期和长期增殖的影响。结果表明,在KYSE170细胞中,BACH1的敲除抑制了短期细胞增殖;但BACH1的过表达不影响KYSE150细胞的增殖。BACH1对细胞的长期生长和存活无影响。因此,BACH1显著增强了ESCC细胞的肿瘤迁移和侵袭能力。
4、BACH1可诱导食管鳞状细胞癌细胞发生EMT
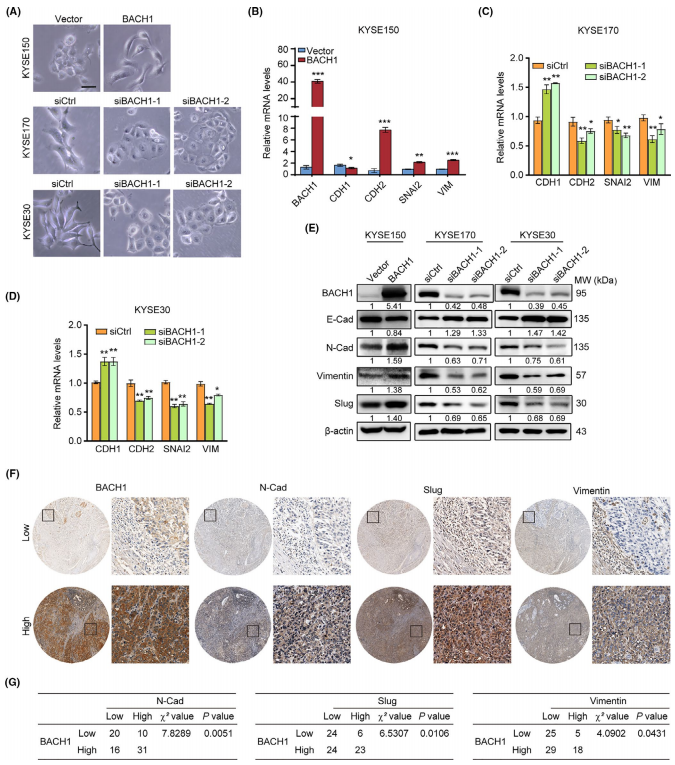
BACH1的过表达和敲除会导致ESCC细胞的形态改变。在KYSE150-BACH1细胞中,BACH1的过表达导致了从上皮细胞表型向间质细胞表型的明显形态转变,使用两种特定的siRNAs使BACH1表达下降导致了显著的上皮形态,一些KYSE170和KYSE30细胞显示了鹅卵石样形态。这些结果提示作者,BACH1是否参与了ESCC细胞EMT的诱导?作者通过qPCR和Western blot分别检测了一些EMT的标记蛋白:E-cadherin、N-cadherin、vimentin和Slug的mRNA和蛋白表达,以论证BACH1对EMT的影响。结果表明,在KYSE30-siBACH1和KYSE170-siBACH1细胞中,BACH1的敲除抑制了N-cadherin、vimentin和Slug的表达水平,增加了E-cadherin的表达水平。相反,在KYSE150-BACH1细胞中,BACH1的过表达增加了N-cadherin、vimentin和Slug的表达水平,减少了E-cadherin的表达水平,这些结果表明BACH1诱导了EMT。 作者通过免疫组化进一步检测77例ESCC组织标本中N-cadherin、Slug和vimentin的蛋白水平,以研究它们与BACH1的表达相关性。卡方检验结果显示,BACH1蛋白的高表达与N-cadherin (P=0.0051)、Slug (P=0.0106)、vimentin (P=0.0431)的高表达呈正相关。因此,这些结果证实BACH1促进了ESCC的EMT。
5、BACH1在ESCC细胞中上调了CDH2转录水平的表达
先前的研究表明,BACH1可以与EMT标志物的启动子直接结合,如:卵巢癌的SNAI2和胰腺癌的FOXA1。作者研究了hTFtarget数据库中针对BACH1的ChIP-seq数据集,以确定BACH1是否与ESCC细胞中其他EMT标志物的启动子结合。GEO: GSE31477数据集的ChIP-seq数据分析结果表明,BACH1与CDH2的启动子区域结合。接下来,作者从UCSC Genome Browser中下载了CDH2启动子区(−4000/+100)序列,利用JASPAR数据库鉴定出一个与BACH1结合的序列,该序列位于CDH2转录起始位点(TSS)上游3446bp。采用抗BACH1抗体或对照IgG对KYSE170和KYSE150细胞进行免疫共沉淀,qPCR结果证实了BACH1与CDH2启动子结合。此外,与之前的研究报道一致,BACH1能够与SNAI2和VIM的启动子区域结合。为了确定BACH1结合位点是否参与了CDH2的转录激活,作者分别构建了含有BACH1结合序列 (Chr18:28180381-28180731,350 bp)的CDH2启动子区域或相应BACH1结合序列的缺失突变的荧光素酶报告基因载体。转染CDH2野生型启动子后,BACH1过表达的KYSE170细胞的荧光素酶活性比对照组KYSE170细胞高两倍。然而,转染CDH2突变启动子后,两组相对荧光素酶活性相似。这些结果证实了BACH1在ESCC细胞中转录激活了CDH2的启动子。
6、BACH1上调VEGFC进而促进血管生成
血管的形成对肿瘤的扩张和转移很重要。先前的研究表明,BACH1在卵巢癌和大肠癌中通过调控VEGFC的表达而促进血管生成。因此,作者研究了ESCC中BACH1与VEGFC的相关性。首先,作者检测到在BACH1表达敲除的KYSE170-siBACH1和KYSE30-siBACH1细胞中VEGFC的mRNA表达水平下降。而在KYSE150-BACH1细胞中,VEGFC的mRNA表达水平升高,这与BACH1的表达增强有关。接下来,作者利用GEO数据(GSE23400)分析了ESCC中VEGFC的表达。ESCC组织中VEGFC的mRNA表达水平明显高于癌旁组织。TCGA-ESCC数据库的Spearman相关分析显示,VEGFC的mRNA表达水平与BACH1的mRNA表达水平呈正相关。此外,KYSE150和KYSE170细胞的ChIP-qPCR检测结果表明,BACH1能够与VEGFC的启动子区结合,并调控VEGFC的表达。由此可见,BACH1可以通过上调VEGFC的转录和促进血管生成而部分促进转移。

7、BACH1在体内促进ESCC细胞的增殖和血管生成
接下来,作者在体内检测了BACH1对肿瘤进展的长期影响。将KYSE170-shBACH1/KYSE170-shCtrl和KYSE150-BACH1/KYSE150细胞皮下注射到裸鼠侧腹,构建异种移植瘤模型,将移植瘤切除并进行检测。检测结果显示,来自KYSE170-shBACH1细胞的肿瘤比来自对照细胞的肿瘤小,由此可见,BACH1的表达敲除显著抑制了肿瘤的生长(P<0.01);此外,来自KYSE150-BACH1细胞的肿瘤比来自对照细胞的肿瘤更大,故而BACH1的过表达促进了肿瘤的生长(P<0.01)。接下来,作者检测了EMT标记物在体内的表达,来自KYSE170-shBACH1和KYSE170-shCtrl细胞的异种移植瘤的免疫组化染色(IHC)结果表明,BACH1基因的表达敲除伴随着N-cadherin、vimentin和Slug在体内的低表达。
此外,作者对异种移植瘤中的血管内皮标记物CD31和VEGFC进行免疫组化和IF染色以评估血管生成。结果表明,与注射对照KYSE170-shCtrl细胞的小鼠相比,BACH1的表达下调显著抑制了皮下注射KYSE170-shBACH1细胞的小鼠移植瘤组织中CD31+血管密度和 VEGFC的表达。与注射KYSE150-Vector对照细胞的小鼠相比,BACH1的过表达显著增加了皮下注射KYSE150-BACH1细胞的小鼠移植瘤组织中CD31+血管密度。这些结果表明,BACH1在异种移植模型中通过促进血管生成和EMT部分地促进肿瘤生长。
研究结论
本研究揭示了BACH1在ESCC中重要的促转移、促血管生成和预后不良的作用。BACH1通过与EMT相关基因:CDH2、VIM、SNAI2和VEGFC的转录启动子区结合,增强了这些基因的转录,从而促进了ESCC的转移和血管生成。作者的研究结果表明,BACH1可能是食管鳞癌潜在的治疗靶点和预后生物标志物。
参考文献
Zhao Y, Gao J, Xie X, Nan P, Liu F, Sun Y, Zhao X. BACH1 promotes the progression of esophageal squamous cell carcinoma by inducing the epithelial-mesenchymal transition and angiogenesis. Cancer Med. 2021 May 1. doi: 10.1002/cam4.3884. Epub ahead of print. PMID: 33932125.





