乳腺癌是妇女最常见的恶性癌症,发病率和死亡率都很高,据报道,2020年的新增病例约为230万例,死亡病例约为68.5万例。大多数乳腺癌的死亡都与远端转移有关,如:肺转移。转移性乳腺癌(mBC)患者大多是在初次治疗后复发的早期乳腺癌患者,部分为新生转移。转移性乳腺癌基本上是一种不治之症,5年生存率约为23.8-30%。因此,了解乳腺癌转移的潜在机制对于开发有效的治疗方法至关重要。
肿瘤抑制因子p53是一种序列特异性的DNA结合转录因子,调控细胞周期阻滞、DNA修复和凋亡等多种细胞功能的相关基因表达。在乳腺癌中,p53通过上调GAS7而抑制转移。p53在侵袭性乳腺癌中经常发生突变,约25-30%的乳腺癌患者,约80%的三阴性乳腺癌(TNBC)患者会发生P53突变,而p53突变的三阴性乳腺癌患者通常预后较差。进一步剖析和确认潜在的p53靶点将有利于转移性乳腺癌的诊断和治疗。
细胞粘附分子(CAMs)是一种膜糖蛋白受体,介导细胞与细胞、细胞与细胞外基质间相互作用,并为细胞粘附、迁移、侵袭和器官特异性转移传递胞内信号。细胞粘附分子包括:钙粘蛋白、选择素、整合素、免疫球蛋白超家族(IgSF)等。2000年首次克隆的免疫球蛋白超家族9 (IGSF9)是IgSF的成员。研究表明,IGSF9在不同癌症类型中异常表达,如:在黑色素瘤、结直肠家族性腺瘤性息肉病中表达下调;在胆囊癌、卵巢癌和子宫内膜癌中表达上调。目前,IGSF9的表达和肿瘤之间的分子机制仍然不清楚,尤其在乳腺癌中。
局部黏着斑激酶(FAK)是一种非受体酪氨酸激酶,作为信号激酶和细胞粘附相关的支架来协调不同细胞骨架相关蛋白paxillin和p130Cas的位置募集和磷酸化。FAK还可与整合素或生长因子受体结合,调控细胞运动、侵袭和存活。有研究表明,FAK参与了肿瘤的发展和进展。FAK在侵袭性或转移性乳腺癌中过表达和激活,与乳腺癌进展和预后不良相关;FAK在乳腺上皮细胞中表达缺失可以抑制肿瘤的形成和转移。
研究路线
研究内容
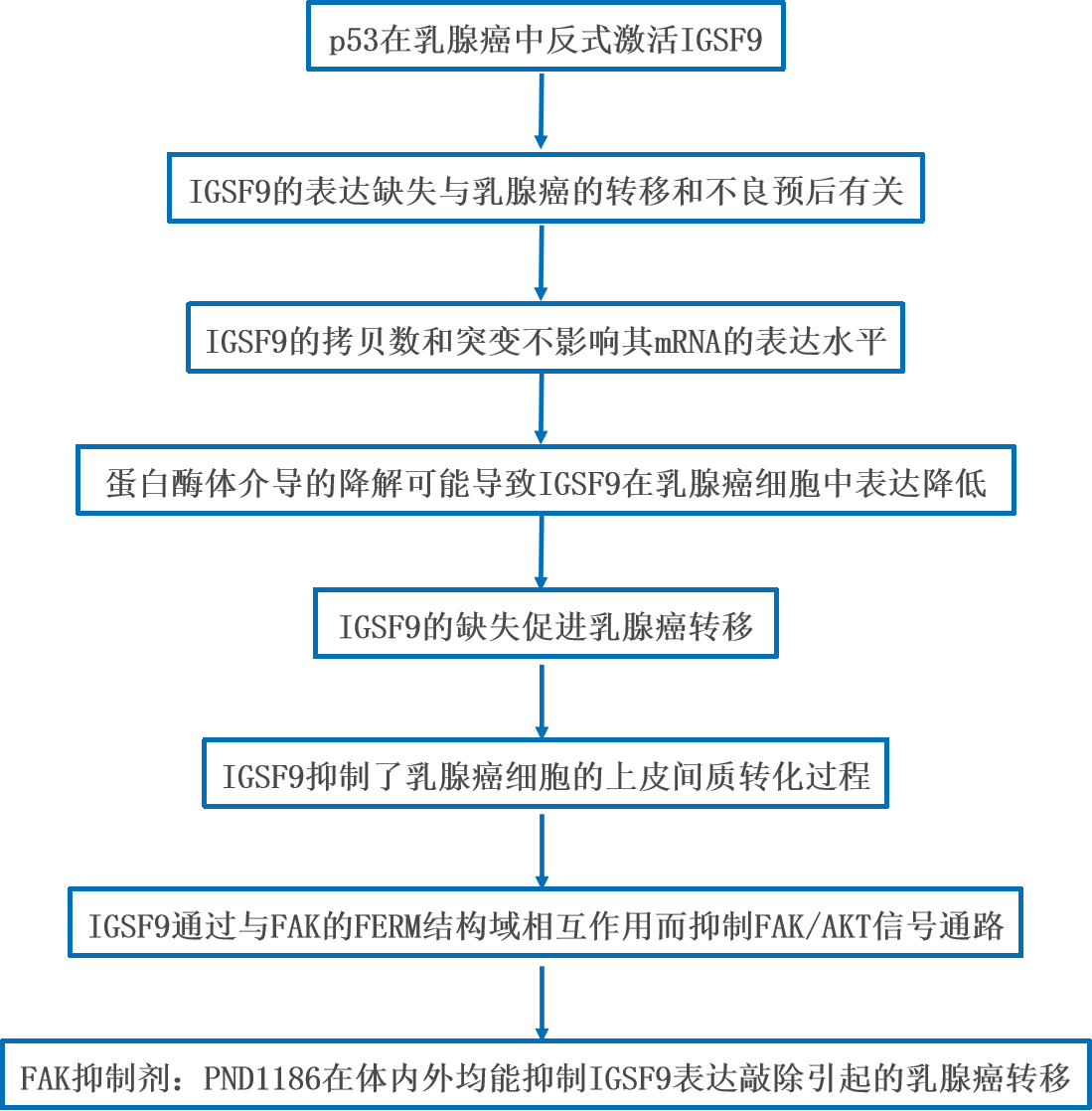
1、p53在乳腺癌中反式激活IGSF9
P53作为一种转录因子,可调节细胞周期、衰老和凋亡等重要的细胞活动。作者利用JASPAR数据库预测了p53的最佳转录结合位点的特征,然后用Chip Atlas、hTFTarget、GTRD和Harmonizome对p53的潜在靶基因进行预测,得到1795个共同的靶基因。GO和KEGG富集分析表明,这些潜在基因主要涉及:粘着斑通路、粘附连接等。作者也利用Metascape进行GO功能和KEGG通路富集分析,探索靶基因的主要功能和通路。这些数据表明,p53调节细胞粘附相关基因(CAMs)。考虑到IGSF9是CAMs的成员,也是p53的潜在靶点(数据来自GTRD数据库),作者进一步利用GeneMANIA构建了TP53和IGSF9的网络,从不同方面探讨了它们之间的相互作用。

作者对TCGA数据集进行分析,以探索p53和IGSF9之间的关系。分析表明,TP53与IGSF9在乳腺癌中的mRNA表达水平呈正相关(Pearson R=0.17, P<0.001)。与正常乳腺细胞MCF-10A相比,p53和IGSF9均在乳腺癌细胞MCF-7中表达下调,提示p53在调控乳腺癌中IGSF9的表达方面具有潜在作用。在结合位点两侧(−3000/+50 bp)设计PCR引物并进行染色质免疫沉淀(ChIP)试验。结果表明,p53可以与IGSF9的启动子结合。
为了进一步确认p53对IGSF9基因表达的调控作用,作者采用荧光素酶报告基因检测一系列IGSF9-luc报告基因(覆盖了启动子区:-3000至+50 bp)的转录活性。结果表明,−183/−116 nt序列启动子活性最高,该区域包含p53结合位点(−137/−131 nt);p53结合位点的缺失和突变显著降低了IGSF9启动子的活性;p53蛋白显著增加了IGSF9的转录活性,而TP53蛋白的表达敲除显著降低了IGSF9的转录活性。同时,TP53的表达敲除显著降低了MCF-7细胞内源性和外源性IGSF9的表达。这些结果表明,p53通过与IGSF9的启动子结合而反式激活IGSF9。
文献表明,R175H、Y220C、G244D、G245S、R248Q、R249S、R273H、R282W等p53的DNA结合域在乳腺癌中的突变频率较高。作者构建了包含这些突变的序列,并进行了荧光素酶活性检测。结果表明,R175H消除了p53反式激活的IGSF9启动子活性,而其他突变没有这种效果。接下来,作者在MCF-7细胞中检测IGSF9的蛋白表达,发现野生型p53的过表达显著增加了IGSF9的蛋白水平,而突变型R175H不影响IGSF9的表达,其他p53突变体对IGSF9的蛋白增加与野生型p53相似。这些数据证实了,野生型p53直接与IGSF9启动子结合并激活IGSF9的表达,而R175H的突变可使这种效果消失。
2、IGSF9的表达缺失与乳腺癌的转移和不良预后有关
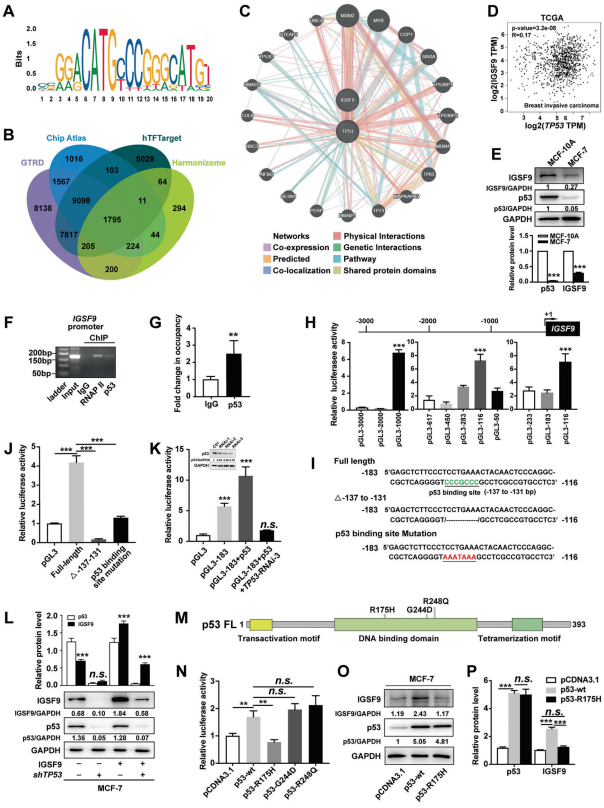
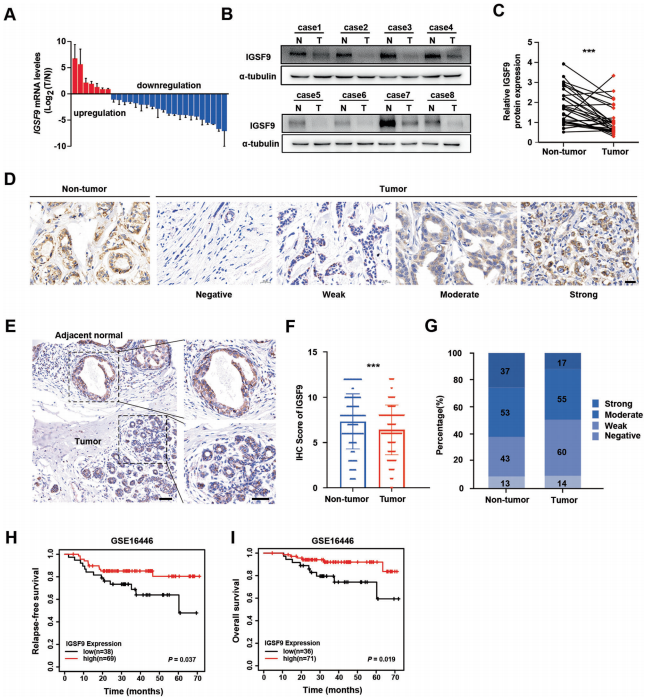
作者采用qRT-PCR对28对乳腺癌肿瘤及癌旁组织中IGSF9的mRNA表达进行了检测。结果表明,IGSF9在75%(21/28)乳腺癌肿瘤中的表达明显低于对应的癌旁组织。western blot分析同样表明,IGSF9在乳腺癌肿瘤中显著下调(P<0.001)。此外,作者收集了160对癌与癌旁配对的乳腺癌标本(手术切除术)进行免疫组化染色。结果表明,IGSF9在细胞内分散分布,与癌旁正常乳腺上皮细胞相比,乳腺癌肿瘤细胞中的IGSF9表达明显下调。
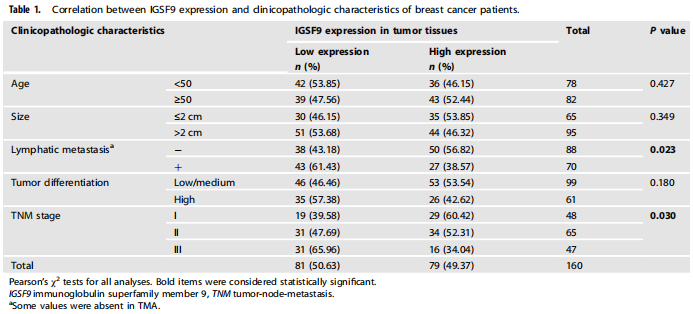
为了评估IGSF9的表达在乳腺癌中的临床意义,作者对IGSF9的表达进行了评分,并根据IGSF9蛋白中位表达水平将患者分为IGSF9高表达组和低表达组。分析表明,IGSF9的低表达与淋巴结转移(P=0.023)和TNM分期(P=0.030)显著相关,而与年龄、肿瘤大小和肿瘤分化无关。在GSE16446数据集中,作者发现与IGSF9高表达的乳腺癌患者相比,IGSF9低表达的乳腺癌患者无复发生存期(RFS)较差(P=0.037),总生存期(OS)较差(P=0.019)。这些数据表明,IGSF9的表达降低与乳腺癌患者预后不良和转移有关,可能是乳腺癌患者的一个有价值的预后不良指标。

3、IGSF9的拷贝数和突变不影响其mRNA的表达水平
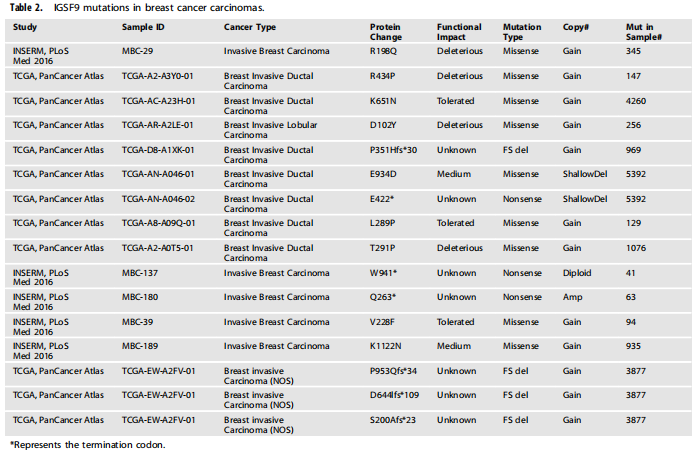
基因改变和表观遗传失活是抑癌基因表达缺失的两个主要原因。为了探索IGSF9在乳腺癌中的基因组改变,作者分析了来自cbiopportal数据库(2012-2021年)中的9555例乳腺癌病例的序列。结果表明,IGSF9拷贝数变化频率为0-21.26%,均为扩增。此外,cBioportal数据库中只有5/16的研究表明IGSF9可能发生突变,IGSF9在这些数据集中的突变的频率均小于3%。IGSF9基因拷贝数的轻度丢失并未造成其mRNA表达的明显下降。这些数据表明,基因拷贝数不是乳腺癌中IGSF9表达水平降低的主要因素。IGSF9的突变模式如下图所示,其中4个突变被多态表型分析工具预测为有害的。COSMIC分析显示,IGSF9启动子中包含p53结合位点的区域没有突变。IGSF9突变的mRNA表达在三个指示数据集中均匀分布,说明IGSF9的突变不影响其在乳腺癌中的mRNA表达水平。
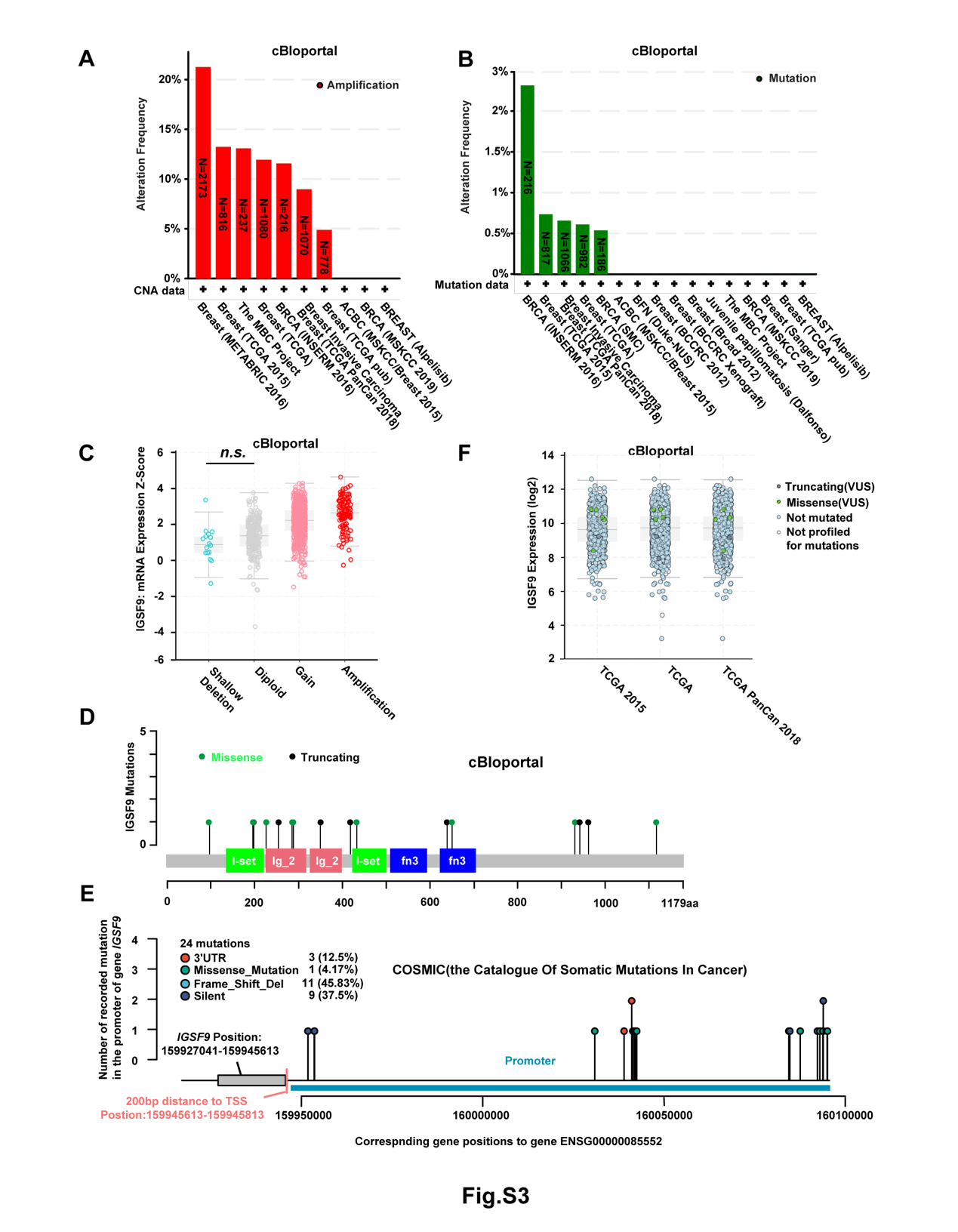
4、蛋白酶体介导的降解可能导致IGSF9在乳腺癌细胞中表达降低
为了研究miRNAs对IGSF9表达的转录后调控作用,作者通过Target scan、miRDB和miRTarBase鉴定出两种潜在的靶向IGSF9 mRNA 3'-UTR的miRNA:miR-2355-5p和miR-8485。荧光素酶报告基因结果表明,hsa-miR-8485和hsa-miR-2355-5p都没有抑制IGSF9 3'-UTR的荧光素酶活性,这表明这两个miRNAs不参与乳腺癌中IGSF9的调控。
作者接下来测试了IGSF9蛋白在乳腺癌中的稳定性。CHX chase实验表明,IGSF9蛋白在乳腺癌细胞中的稳定性低于正常乳腺细胞:MCF-10A。MG132(蛋白酶体抑制剂)显著增加了MCF-10A和MCF-7细胞中的IGSF9蛋白水平;而NH4Cl(溶酶体抑制剂)的处理没有变化。这些数据表明,蛋白酶体介导的降解可能导致了乳腺癌细胞中IGSF9蛋白水平的降低。

5、IGSF9的缺失促进乳腺癌转移
为了研究IGSF9在乳腺癌细胞增殖和转移中的作用,作者将IGSF9在MCF-7和T47D细胞系中稳定过表达,在MDA-MB-231和MDA-MB-468细胞系中表达敲除。western blot验证了IGSF9蛋白水平的过表达和干扰效率。CCK-8增殖和集落形成试验都表明,IGSF9过表达或敲低对细胞的增殖能力均没有影响。然而,伤口愈合和transwell迁移实验结果表明,IGSF9的过表达抑制了MCF-7和T47D细胞的迁移,而IGSF9的表达敲除促进了MDA-MB-231和MDA-MB-468细胞的迁移。transwell侵袭试验一致表明,IGSF9的过表达导致细胞侵袭能力显著降低,而IGSF9的表达敲除导致乳腺癌细胞侵袭能力增强。这些数据表明,IGSF9的表达缺失促进了乳腺癌的体外转移。此外,IGSF9的过表达抑制了TP53表达敲除所诱导的MCF-7细胞得迁移和侵袭,提示IGSF9可以恢复TP53表达敲除所诱导的乳腺癌转移。
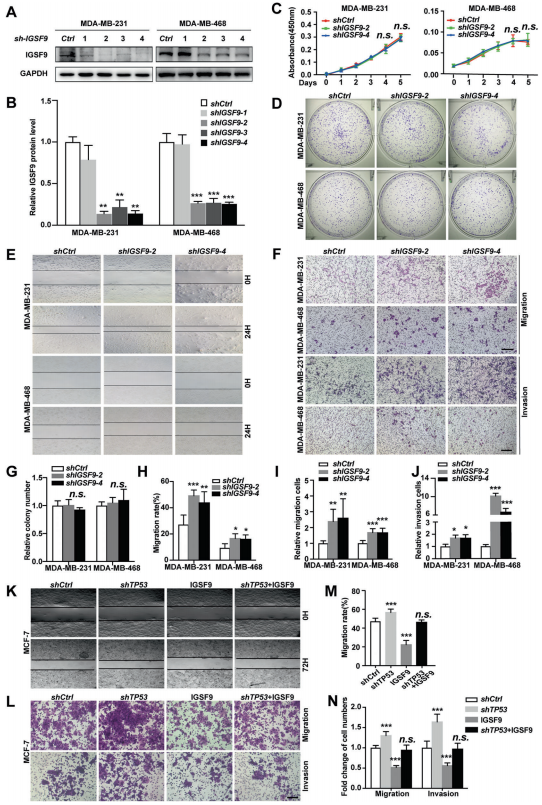

6、IGSF9抑制了乳腺癌细胞的上皮间质转化过程
上皮间质转化(EMT)在乳腺癌、结直肠癌等上皮源性肿瘤中促进肿瘤的侵袭转移,起着重要且复杂的作用。作者对IGSF9表达下调的乳腺癌细胞进行western blot和免疫荧光分析,检测到了典型的EMT表型,即:E-cadherin和ZO-1表达下调,N-cadherin和MMP2表达上调。相反,在IGSF9过表达的乳腺癌细胞中,EMT表型被抑制。作者通过尾静脉注射乳腺癌稳定细胞悬浮液构建了肺转移模型。肺转移结节的Micro-CT和HE染色均证实,IGSF9表达敲除的MDA-MB-231细胞导致了肺转移负担增加。
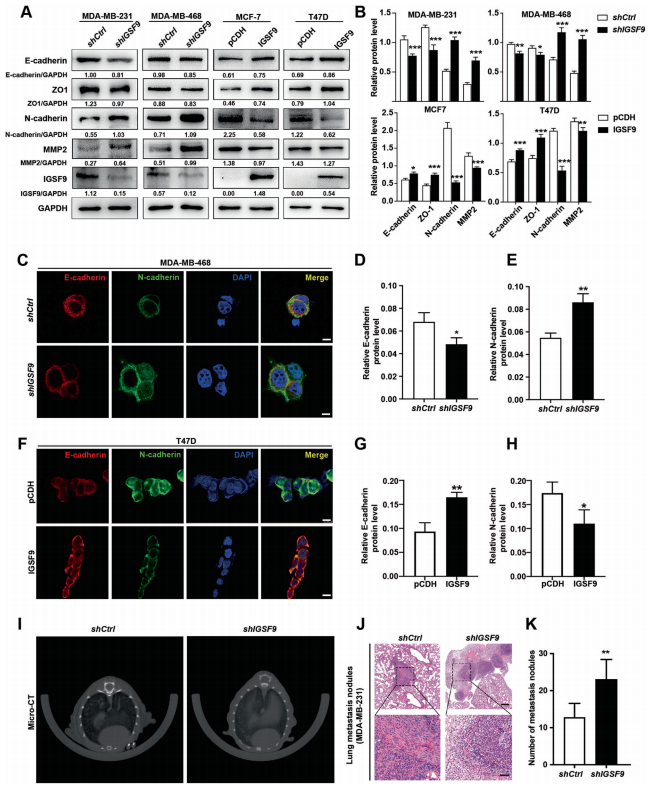
7、IGSF9通过与FAK的FERM结构域相互作用而抑制FAK/AKT信号通路
为了探索IGSF9抑制肿瘤的潜在分子机制,作者分析了GSE27830数据集中IGSF9高表达和低表达样本间的差异表达基因,并对差异基因进行KEGG富集途径分析。分析表明,富集通路主要包括:粘着斑、PI3K-AKT信号通路、ECM受体相互作用和细胞粘附分子。
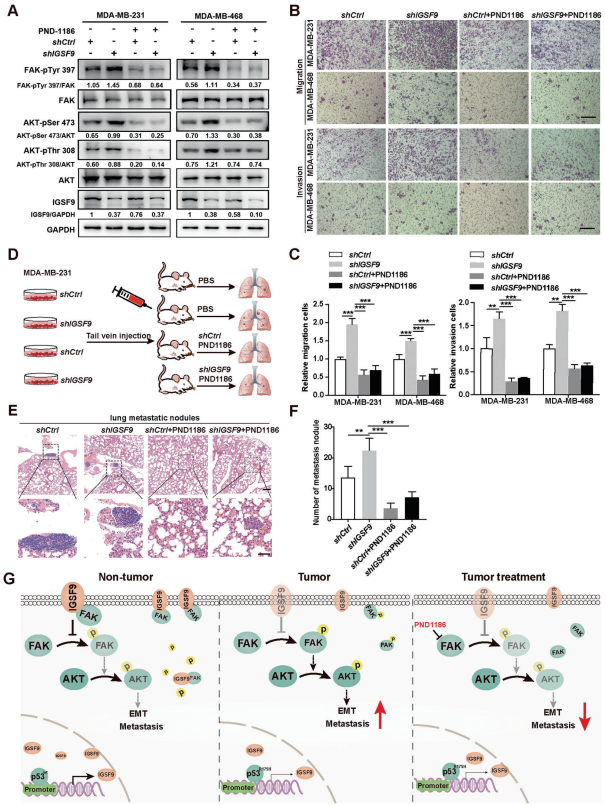
文献表明,FAK作为信号激酶和细胞粘附相关的支架蛋白参与了乳腺癌转移。IGSF9的结构使其能够作为一种潜在的细胞表面受体,并将外界信号转导入细胞内。免疫荧光显示,IGSF9和FAK在细胞内共定位。此外,免疫共沉淀实验显示,IGSF9和FAK在MCF-7细胞和HEK-293T细胞中分别存在内源性和外源性相互作用。为了确定FAK中与IGSF9相互作用的区域,作者将各种HA标记的FAK片段与IGSF9共表达,并进行免疫共沉淀实验。结果表明,含有FERM域的FAK (1-355 aa)可以与IGSF9结合。同时,作者还将FAK与各种Myc标记的IGSF9片段共表达。结果表明,含有5个Ig域的IGSF9 (1-493 aa)可以与FAK结合。体外翻译的IGSF9 (1-493 aa)可以被纯化的GST-FAK (1-355 aa)融合蛋白下拉,表明IGSF9 (1-493 aa)和FAK (1-355 aa)可以直接相互作用。根据蛋白质数据库中的x射线晶体结构预测了IGSF9-FAK的复合物结构模型。对接建模数据表明,IGSF9的R6、L63、L64、D80、E101和R109氨基酸以及FAK的S269、H292、L293和E325氨基酸是二者相互作用的关键。作者在IGSF9过表达或表达敲除的细胞中研究了FAK/AKT通路关键分子的活性。结果表明,p-FAK (Y397)、p-AKT (S473)和p-AKT (T308)在IGSF9过表达的MCF7和T47D细胞中显著降低,表明FAK/AKT信号通路受到抑制。相反,FAK/AKT信号通路在IGSF9表达敲除的MDA-MB-231和MDA-MB-468细胞中被激活。这些结果表明,IGSF9与FAK相互作用并抑制FAK/AKT信号通路。

8、FAK抑制剂:PND1186在体内外均能抑制IGSF9表达敲除引起的乳腺癌转移
作者使用特异性FAK抑制剂:PND1186处理MDA-MB-231和MDA-MB-468细胞。Western blot分析表明,IGSF9表达缺失所介导的FAK/AKT信号激活,可以被PND1186明显阻断。Transwell迁移和侵袭实验还表明,PND1186能显著逆转IGSF9表达敲除所诱导的MDA-MB-231和MDA-MB-468细胞的迁移和侵袭。此外,作者通过将MDA-MB-231细胞尾静脉注射到4-6周雌性NOD-SCID小鼠,建立了肺转移模型。6周后处死小鼠,肺组织切片进行HE染色。肺转移灶数量表明,IGSF9的表达敲除加速了肿瘤转移,PND1186的处理可以逆转肿瘤转移。这些数据表明,IGSF9的表达缺失通过激活FAK/AKT信号而诱导乳腺癌转移。PND1186可能在未来应用于乳腺癌的治疗。
研究结论
作者发现IGSF9是一个新的p53靶点,野生型p53通过与IGSF9的启动子结合而反式激活其转录活性。IGSF9的表达缺失与乳腺癌转移和预后不良相关。在机制上,IGSF9的表达缺失通过激活FAK/AKT信号,进而促进EMT过程,从而导致乳腺癌转移。
本研究表明,IGSF9是一个可行的预后生物标志物,IGSF9/FAK轴可能是乳腺癌治疗的潜在靶点。同时,作者也证明了,FAK抑制剂:PND1186在体内外均能抑制IGSF9的表达敲低所引起的乳腺癌转移。
参考文献
Li, Y., Deng, Y., Zhao, Y. et al. Immunoglobulin superfamily 9 (IGSF9) is trans-activated by p53, inhibits breast cancer metastasis via FAK. Oncogene (2022). https://doi.org/10.1038/s41388-022-02459-8





